
免疫组化: 改善 IHC 染色的概述 + 步骤


免疫组化简介
组织学中使用免疫组化 (IHC) 来检测是否存在有助于对肿瘤进行准确分类和诊断的特定蛋白质标志物。 本指南说明用于进行 IHC 染色的基本步骤。
IHC 染色简介
组织学中使用免疫组化 (IHC) 来检测标本中是否存在有助于对肿瘤进行准确分类和诊断的特定蛋白质标志物。 随着技术的不断发展,免疫组化被用作苏木精和伊红 (H&E) 染色以及特殊染色技术等这些经常用于显示组织形态(结构)的组织学方法的补充。 如果 H&E 和特殊染色不具有特异性,IHC 将能够指示特定的蛋白质标志物或其他标志物。 IHC 被用作诊断工具,用于帮助诊断实体瘤和细胞学标本,并已成为近半个世纪以来的主流诊断工具。
靶抗原
抗原是细胞内或细胞表面的蛋白质。 病理学家通过寻找是否存在特定抗原,以帮助诊断。
已发现成百上千个具有诊断价值的抗原。 通常,病理学家将使用一个包含多种抗原的“检测组合”对特定肿瘤进行全面分类。
一抗
IHC 的第一个阶段是应用能够特异性结合靶抗原的一抗。
主要有两种类型的一抗:多克隆抗体和单克隆抗体。 多克隆抗体与多个表位(或部分)或靶抗原具有亲和力,并且可与其结合,因此更容易与非靶抗原发生交叉反应。
单克隆抗体仅对一个表位具有亲和力,倾向于产生更清晰、更具特异性的染色,但灵敏度或强度较低。
二抗
接下来,二抗与一抗结合。 这被称为间接 IHC。 通常使用多种二抗与一种一抗结合,以增强染色强度。
检测系统
检测系统建立在二抗之上。 现代显色检测系统利用与抗体偶联(结合)的辣根过氧化物酶 (HRP) 等酶进行检测。 与抗体结合的多种酶被称为聚合物,由于存在可供显色剂结合的更多分子,它们再次产生更强烈的染色。
显色剂
最后,底物形成可在显微镜下观察到的不溶性显色沉淀。 有两种常用的显色剂: DAB(棕色)或 AP(红色)
DAB 适用于大多数应用,因为它可以提供强烈的持久性染色。 AP 红(或另一种红色显色剂)主要用于皮肤切片,因为在这种情况下,棕色 DAB 可能被棕色黑色素的色素颗粒所掩盖。
有时可以在同一组织切片上同时使用 DAB 和 AP 红,使病理学家能够在一张玻片上观察两种抗原。 这一过程被称为双染。
已完成的 IHC 染色
这是一种典型的 IHC 染色,其中棕色沉淀物表明存在靶抗原——该病例为前列腺活检组织中的细胞角蛋白 5 染色。 染色量、染色模式和染色位置(细胞质、细胞核或细胞膜)均可为诊断病理学家提供信息。
蓝色背景是一种苏木精复染,通常在应用显色剂后进行。 复染与显色剂形成对比,也可以帮助病理学家观察深层组织结构。
改善 IHC 的 15 个步骤
为制备组织学检查标本,从患者到病理学家都需要谨慎、熟练和并对规范烂熟于心。 本指南为达到最佳实践技巧提供了可操作性的建议和避免出现常见错误的简便方法。
本节重点强调了改善 IHC 的技巧。 我们希望能够为每个步骤提供宝贵的组织学规范提醒,并且在发生不符合要求的结果时能够帮助排除问题。
想要查看改善组织学处理的所有 101 个步骤?
步骤 1 - 使用高质量切片
特别注意应使用已彻底干燥的平整切片来制备玻片。 最好使用带电荷载玻片或 APES 涂层载玻片进行 IHC 检测。
不均匀、粘合不良的切片,染色不均匀,背景染色杂乱。
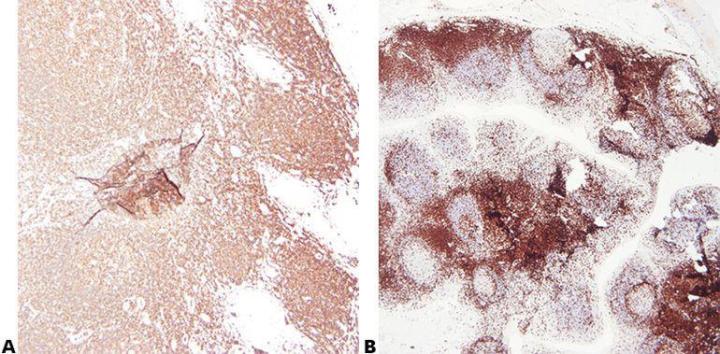
步骤 2 - 确保最佳固定
使用已知且一致的固定条件(固定液类型、pH 值、温度、时间)进行高质量固定可产生最佳结果。 处理前应检查标本,以确定是否需要进一步固定。
固定条件不一致,组织固定不足或过度固定,则会获得不一致的结果,并且问题排除起来非常困难。

步骤 3 - 避免粘合问题
避免在浮选槽中使用含蛋白质的切片粘合剂(胶水、淀粉或明胶),尤其是带电荷载玻片上。
含蛋白质的粘合剂会遮盖带电荷载玻片的表面。 这会导致不均匀粘合,并且由于 IHC 试剂汇集在翘起的切片下方而导致不均匀染色。

步骤 4 - 避免浓度梯度
应用试剂时应小心避免形成浓度梯度。
“我们有时会看到玻片一端为强染色,而另一端为弱染色。”

步骤 5 - 谨慎选择抗体
根据敏感性和特异性谨慎选择一抗。 请注意,不同供应商销售的抗体通常为同一来源,经过重新包装/贴牌后销售。 在评估抗体时,请务必使用克隆名称。
“我们购买抗体时只看价格。”
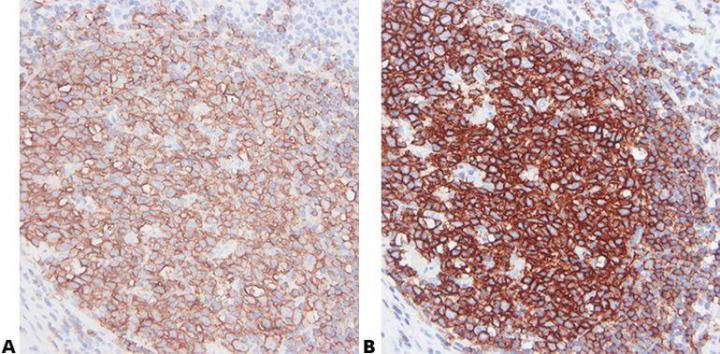
步骤 6 - 阅读说明书
了解您的一抗。 确保阅读过说明书,以确定您的方法对于特定抗体的适用性。 当购买新的抗体批次时,应更新说明书。
“我们无法获得我们实验室的抗体说明书。”
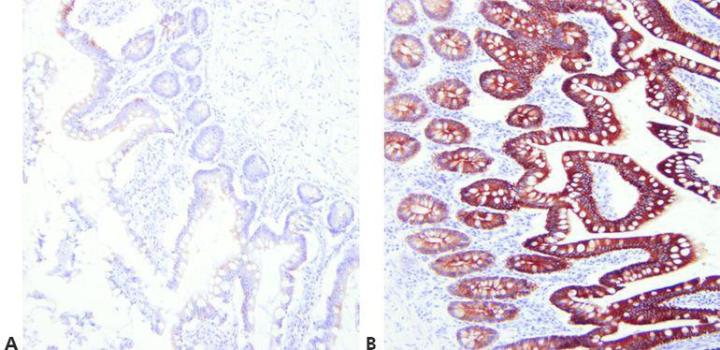
步骤 7 - 优化抗原修复方法
为所用的一抗、所要染色的组织以及所采用的固定方法选择合适的抗原修复条件(pH、试剂、反应条件)。
如果存在合适的通用 HIER 方法,可对所有一抗采用相同的抗原修复技术。
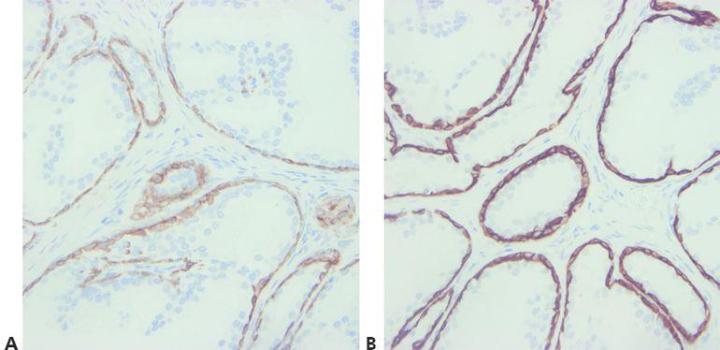
步骤 8 - 考虑到抗体交叉反应性
注意任何潜在的抗体交叉反应性问题(阅读说明书)。
从不尝试探究异常阳性染色的原因。

步骤 9 - 阻断内源性过氧化物酶
对于基于过氧化物酶的检测系统,应始终使用过氧化物酶阻断步骤。
非特异性染色常见于红细胞、粒细胞、单核细胞和肌肉。 这是由于未完全阻断内源性过氧化物酶。

步骤 10 - 避免背景染色
始终采用恰当的蛋白封闭液。
由于蛋白封闭液无效,有时可见全局背景染色。

步骤 11 - 使用适当的检测系统
选择适当的检测系统,可以提供具有充分灵敏度的精确、特异性染色。
“我们使用同一种检测系统很长时间了,似乎没有理由进行更改。 有时我们的染色很弱,并且不像我们预期的那样精确。”
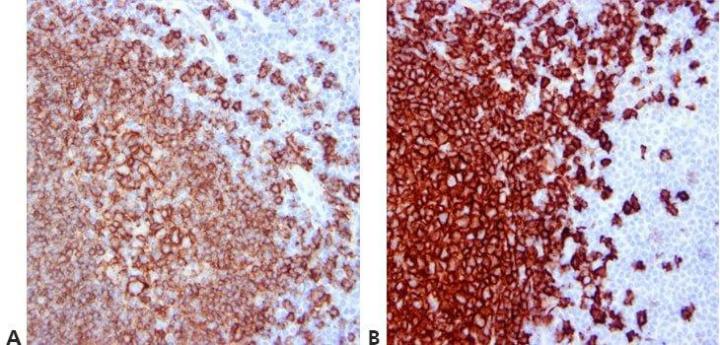
步骤 12 - 标准化清洗步骤
在整个过程中使用标准化清洗步骤(持续时间、体积和搅拌形式)。 这将确保结果的一致性。
使用相同抗体进行的同一批检测中以及不同日期的检测批次之间结果存在高度变异性。 这可能是因为不同操作员使用了不同清洗技术。
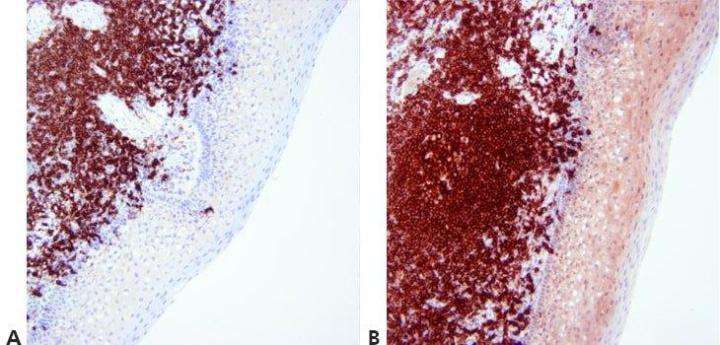
步骤 13 - 优化复染
细胞核复染水平经过仔细调整和标准化,以免掩盖阳性染色。 复染应提供显色剂和背景组织元素之间的最佳对比度。 应针对所用显色剂选择适当的复染剂。
核复染有时非常强。 这可能掩盖弱的特异性染色。

步骤 14 - 使用适当的对照
始终使用适当的阳性和阴性对照,仔细检查结果是否有效。 内部阳性和阴性对照也很重要,为确保 IHC 的质量提供了一种很好的方法。
“只有当我们的方法似乎不起作用时,我们才使用对照。如果每次检测都使用对照,则没有人会对它进行观察。”

步骤 15 - 认真评估结果
在染色后评估检测切片以及对照时,应知道要观察的内容及其位置。
如果在检测切片中观察到染色,则认为染色符合要求。

额外提示: 选择正确的抗体
一个简单但有时被忽视的步骤是选择用于免疫组化的抗体。 这可以避免以后出现大量棘手问题。 搜索来自文献、供应商和同行的特定抗体。
对于抗体来说,需要记住几个重要问题。 其他实验室好用的抗体不一定最适合您的实验室。 每种抗体都需要使用您的染色系统进行检测。 时间过久的抗体会失去染色强度。 暴露于空气和光照也会导致这种情况。
浓缩物与 RTU 抗体
选择抗体时,需要考虑两种主要方式;浓缩物或预稀释的即用型 (RTU) 溶液。 浓缩物使用灵活,初次购买价格较低,通常可在任何染色系统内使用,自动和手工染色均可,需遵照制造商建议。 可以优化浓缩物的工作稀释度,以平衡成本、染色时间和质量。 由于工作稀释度范围大,可随时更改浓缩物,以适应实验室规范的变化或特定抗体的多个方案。 但是,使用浓缩物时需要花费时间来准备和验证。 由于没有确定稀释抗体特性和稳定性的确切方法,而且没有良好对照和规范执行的检测步骤,无法注意到一些细微的恶化,染色质量可能会受到影响。 RTU 的优点包括可以提高实验室效率、更好的质量控制和更方便的试剂管理。 它们可以节省工作稀释、制备和验证测定所需花费的时间。 批间变异性也不会降低一致性,特别是与自动染色仪和相关检测系统一起使用时。 由于具有规定的检测数量和经过生产商验证的有效期,RTU 可简化抗体管理。 此外,随着验证工作量大大降低,通过 RTU 可以轻松采用新的抗体测定方法,从而促进实验室发展。
额外提示: 预染标准化至关重要
任何病理学家、实验室经理或组织学技术人员都承认 IHC 染色的准备过程从获得组织的那一刻开始。 文献记录了组织固定、处理和切片以确保维持形态和抗原性的的最佳条件。 可以进一步采取保持一致性的改善措施,以便对这些因素进行正确控制。 这可能涉及到采集地点的实验室自身建设,因为登记和样本制备均始于此。
自动登记、LIS 和标本追踪基础设施应从实验室延伸到手术/活检地点,从而能够对标准化的前期步骤和设施(“受控”设备、固定液)进行监测,优化下游处理。 认识到这一价值的一个平行行业是血液分析实验室,其采用带有条形码编码患者信息的标准化涂层采血管进行追踪和登记。
将固定、组织处理和 IHC 染色关联在一起可以提升质量控制的价值。 可监测和记录固定和组织处理条件并将其与 IHC 染色方案相关联的实验室能够在更严格的质控环境下报告诊断。 频繁采用控制措施来控制预处理变异(例如每 100 张玻片进行质控)也可以使染色仪器提供良好的容差和性能。 随着 IHC 行业的成熟,这些工作流程和技术将不断进步。 然而,已知有许多规范可以帮助确立和维持高质量和一致的 IHC 染色结果(表)。
| 处理 | 地点 | 影响 IHC 的常见问题 |
|---|---|---|
|
切除/活检 |
手术室/医生办公室 |
»» 切除设备对组织造成机械损伤 |
|
登记 |
实验室 |
»» 标本错误标记 |
|
巨检 |
实验室 |
»» 切片太厚 |
|
组织脱水 |
实验室 |
»» 脱钙不良(如需要) |
|
包埋 |
实验室 |
»» 方向不正确 |
|
切片 |
实验室 |
»» 刀片质量差或刀片类型不正确 |
|
浮选 |
实验室 |
»» 脏水或污染的水 |
About the presenters

James Anderson is a Global Marketing Manager at Leica Biosystems with experience with histology and scientific, technical, and marketing communications.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.

Steven Westra is a renowned antibody staining consultant with over ten years of experience in the immunohistochemistry industry.
Leica Biosystems Knowledge Pathway content is subject to the Leica Biosystems website terms of use, available at: Legal Notice. The content, including webinars, training presentations and related materials is intended to provide general information regarding particular subjects of interest to health care professionals and is not intended to be, and should not be construed as, medical, regulatory or legal advice. The views and opinions expressed in any third-party content reflect the personal views and opinions of the speaker(s)/author(s) and do not necessarily represent or reflect the views or opinions of Leica Biosystems, its employees or agents. Any links contained in the content which provides access to third party resources or content is provided for convenience only.
For the use of any product, the applicable product documentation, including information guides, inserts and operation manuals should be consulted.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.