
标本处理简介

对细胞和组织进行显微镜分析需要制备非常薄且质量高的切片(薄片),切片封装在玻片上并适当染色,以展示正常和异常结构。
大多数新鲜组织非常脆弱,容易变形受损,因此无法用来制备薄切片,除非它以化学方式保存或“固定”,并在切割时有某些方式可以提供支持。概括地讲,可以采用两种策略来提供这种支持。
- 我们可以冷冻组织,在切切片时保持冷冻状态。这些切片被称为“冷冻切片”。
- 另外,我们也可以用可以进行液体-固态转换的物质来浸润组织标本,这样就可以从组织标本中切出薄片,石蜡就是这样一种介质,这就产生了所谓的“石蜡切片”。
这篇文章描述了处理组织的方法,以制备石蜡包埋标本用于切片。
简介
“组织处理”描述了将动物或人体组织从固定转换到使用合适的组织学专用蜡完全浸润、且包埋后准备好可以在切片机上进行切片的状态所需的步骤。
组织处理可以手动进行(手工处理),但如果必须处理多个标本,则使用自动组织处理机(“组织处理机”)会更方便、更高效。这些设备自 20 世纪 40 年代起就投入使用了1,并慢慢发展为使用更安全、可处理更多数量的标本、处理速度更快并且可产生质量更好的结果。这类处理机有两种主要类型:组织转移(或“浸泡式”)机器(可在容器间转移标本来处理),或流体转移(或“封闭式”)类型(可将标本固定在单处理室或脱水缸中,并按需泵入和泵出流体)。大部分现代流体转移处理机都采用高温、有效流体循环和真空/压力一体式循环来提高处理效率,缩短处理时间。
现代封闭式组织处理机



组织处理的重要性
大多数实验室主管会向工作人员强调组织处理的重要性。值得强调的是,使用不当处理时间表或犯了根本性错误(可能在处理试剂补充或排序时)可能会导致无法制成切片的组织标本,进而无法提供任何有用的显微镜下信息。如果您正在处理整个标本已经过处理(“全部”)的诊断性人体组织,这可能会导致惨重的损失。没有备用组织。没有诊断结果。但是必须向患者作出解释。
尽管组织处理机偶尔会发生机械或电气故障,但在组织实际受损的情况下,处理事故主要是人为失误导致的。强调适当教育和培训对执行组织处理的人员的价值,以及在设置处理机进行任何处理运行时需要特别谨慎,这一点很重要。
石蜡切片用组织处理的步骤概述
1. 获取新鲜标本
新鲜组织标本有各种来源。应当注意的是,在从患者或实验动物身上取下时,它们很容易受损。请务必在切开后尽快小心处理和适当固定。理想情况下,应在切除位置固定,或可能在手术室进行,如果无法进行,应在送到实验室后立即固定。
2. 固定
将标本放入液体固定试剂(固定剂)中,如甲醛溶液(福尔马林)。固定剂将缓慢渗透组织,导致化学和物理变化,从而使组织变硬,便于保存,并使组织免受后续处理步骤的影响。2可用于固定的试剂数量有限,因为它们必须具有适用于这种目的的特定属性。例如,组织组分必须保留一些化学反应性,以便随后可以应用特定的染色技术。3 对于将被处理用来制备石蜡切片的组织,福尔马林(通常用作磷酸盐缓冲溶液)是用于保存的最常用固定剂。理想情况下,标本应保留在固定剂中足够长时间,以让固定剂能够渗透到组织的每个部分,然后再额外保留一段时间让固定化学反应达到平衡(固定时间)。通常,这意味着标本应该固定 6-24 小时。大多数实验室将使用固定剂步骤作为在处理机上的第一步。
固定后,标本可能需要进一步切开,以选择适当的部位进行检查。待处理的标本将放在合适的贴标包埋盒(小孔篮)中,以便将其与其他标本隔离开。处理标本使用的处理时间表持续时间取决于最大和最小标本的类型和尺寸、采用的特定处理机、所选的溶剂、溶剂温度和其他因素。以下示例基于适合在 Leica Peloris™ 快速组织处理机上使用的 6 小时时间表。
3. 脱水
熔化后的石蜡有疏水性(不可与水混溶),因此在用蜡浸润前,必须去除标本内的大部分水。一般通过将标本浸入一系列浓度渐增的乙醇(酒精)溶液直至达到纯净无水乙醇来进行这个过程。乙醇在所有比例下均可与水混溶,因此,标本中的水逐渐被乙醇替代。使用一系列渐增的浓度来避免组织过度变形。
对于厚度不超过 4 mm 的标本,一般的脱水顺序为:
- 70% 乙醇 15 分钟
- 90% 乙醇 15 分钟
- 100% 乙醇 15 分钟
- 100% 乙醇 15 分钟
- 100% 乙醇 30 分钟
- 100% 乙醇 45 分钟
此时,除了微量残留的强结合(分子)水外,应去除标本中所有的水。
4. 清除
遗憾的是,虽然组织现在基本上无水了,但我们仍然无法用蜡浸润,因为蜡和乙醇很大程度上不混溶。因此,我们必须使用一种与乙醇和石蜡完全混溶的中间溶剂。这种溶剂将替换组织中的乙醇,然后又能被熔化的石蜡取代。该过程中的这个阶段称为“清除”,所使用的试剂称为“清除剂”。选择“清除”一词,是因为许多(并非全部)清除剂因其相对较高的折射率会给组织带来透光或透明效果。清除剂的另一个重要作用是去除组织中的大量脂肪,否则脂肪会阻碍浸蜡。
常用的一种清除剂是二甲苯,但需要发生多种变化才能完全替换乙醇。
对于厚度不超过 4 mm 的标本,一般的清除顺序为:
- 二甲苯 20 分钟
- 二甲苯 20 分钟
- 二甲苯 45 分钟
5. 蜡浸润
现在可用合适的组织学专用蜡浸润组织。虽然许多不同的试剂已针对此目的经过多年的评估和使用,但石蜡基组织学专用蜡是最受欢迎的。一般的蜡在 60°C 下是液体,在此温度下可浸润到组织中,然后冷却到 20°C,使其凝固到可始终切成切片的稠度。这些蜡是纯化石蜡和各种添加剂(可能包括树脂,如苯乙烯或聚乙烯)的混合物。应当认识到,这些蜡制剂具有非常特殊的物理特性,可使经蜡浸润的组织切成厚度低至至少 2 µm 的切片,在切片机上切割成切片时形成带状,并保留充分的弹性,以在温水浴上漂浮过程中完全变平。
对于厚度不超过 4 mm 的标本,一般的浸润顺序为:
- 蜡 30 分钟
- 蜡 30 分钟
- 蜡 45 分钟
6. 包埋或封闭
由于标本用蜡彻底浸润了,会形成一个“块”,可夹固在切片机中用于切片。该步骤使用“包埋中心”进行,其中模具填充有熔化的蜡和标本。在模具中要非常小心地定向标本,因为它的放置将决定“切片平面”,这是诊断和研究组织学中的一个重要考虑因素。将一个包埋盒放在模具顶部,加上更多的蜡,将整个块放在冷凝板上固化。完成这个操作时,带有附上的包埋盒的组织块可从模具中取出,并准备好进行切片切割。应当注意的是,如果正确进行组织处理,则含有组织标本的蜡块会非常稳定,可作为存档材料的重要来源。


“无二甲苯”处理
虽然二甲苯广泛用作组织处理的清除剂,但它是一种有毒试剂,有些实验室更喜欢使用毒性较小的替代物,例如异丙醇或其他二甲苯替代物。使用这种方法时若想获得成功,则需要更高的蜡温度,才能在浸润过程中清除标本中的异丙醇。

优化处理和包埋的步骤
从患者到病理学家,制备用于组织学检查的组织标本需谨慎、技能和完善的程序。本指南提供了有关最佳实践技巧的实用建议,以及避免出现常见错误的简便方法。
本指南中强调了优化组织处理和包埋的技巧。我们希望每个步骤均提供宝贵的良好组织学实践提示,并在发生不可接受的结果时能够帮助排除问题。
想要查看优化组织学的所有 101 个步骤?
步骤 20 - 使用适当的时间表
根据组织类型和大小选择适当的时间表。
选择不合适的时间表。例如,小型内镜活检选择了很长的时间表,或大型多脂肪乳腺标本选择了很短的时间表。
步骤 21 - 提供额外固定
为了实现最佳处理并获得良好的形态,组织应在处理前固定好。如果标本未完全固定,则在处理时间表中提供额外的福尔马林固定步骤。
未完全固定的标本会直接进入产生乙醇的分区固定(福尔马林固定适用于标本外部,乙醇固定适用于更深部位)。
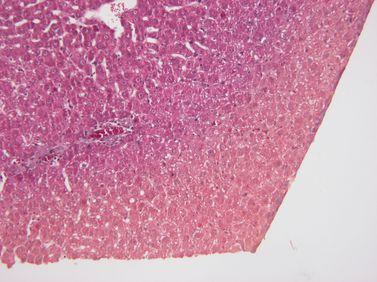
步骤 22 - 保持试剂质量
处理试剂严格按照已确立的指南进行替换(理想情况下,在 Leica Biosystem 的 PELORIS 等高级组织处理机中使用试剂管理系统)。
忽略了处理试剂的替换指南,意味着使用的是无效、被污染或稀释的试剂(例如,忽略 PELORIS 试剂管理系统发出的“超出阈值”警告)。这会导致处理质量不佳。
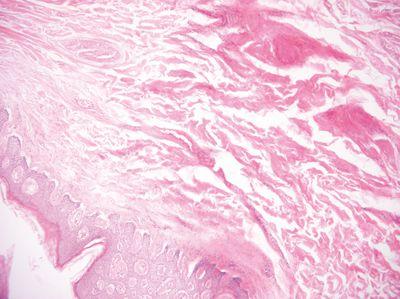
步骤 23 - 使用高质量的蜡
高质量蜡用于浸润,尤其是用于包埋(封闭)以确保得到易于切割的高质量标本块。
使用来源鲜为人知的廉价劣质蜡浸润和包埋。劣质蜡会产生难以切割的组织块。

步骤 24 - 避免危险的试剂
如有可能,使用无二甲苯的方案(例如使用 Leica Biosystems 的 PELORIS 时可用的方案)。这在不影响处理质量的情况下提供了一个更安全的实验室环境。
不考虑使用二甲苯带来的健康影响。尚未考虑使用替代方案的可能性。

步骤 25 - 小心定向标本
小心定向标本。充分的巨检可确保大多数标本的表面平坦。进行包埋的工作人员可随时访问每个标本的描述,并接受相应培训。
定向不正确。这可能会导致组织丢失,因为需要重新包埋。一些制备不佳的标本需要在切片机上大量修剪,才能获得完全覆盖的切片。
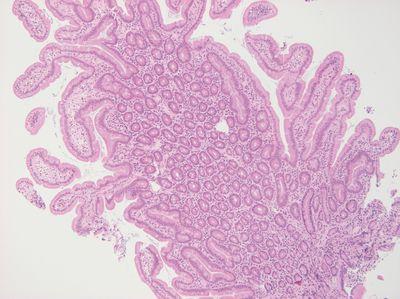
步骤 26 - 选择适当的模具
始终为每个标本选择尺寸合适的模具。
每个标本使用的模具尺寸相同。组织通常会接触到模具边缘。


步骤 27 - 轻轻地处理标本
在包埋过程中轻轻地处理标本。
在包埋过程中用力处理标本,将标本平放在模具中。这个过程可能会导致某些组织破裂。
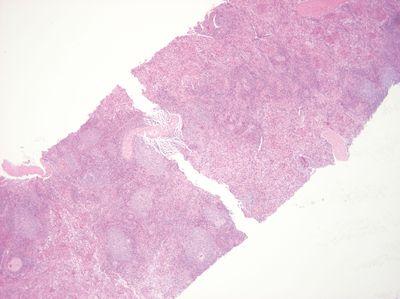
步骤 28 - 避免过热
在处理组织之前,将钳子加热至蜡刚好熔化的点。
将钳子加热至远超出蜡熔点。这可能会导致局部热损伤以及接近接触点的部位发生形态变化。
步骤 29 - 定期检查温度
定期检查包埋中心热板和蜡储存罐的温度。
从未检查过包埋中心热板的温度。即使在这个处理阶段,标本也可能会因局部过热而受损。
步骤 30 - 不要过度灌模
模具灌装到最佳水平且不溢出。
模具过度灌装时,需要在切片前刮削包埋盒的背部和边缘。过度灌装的组织块在置于切片机夹头时可能会不平坦,导致不稳定,从而可能使组织在切片切割期间受损。

About the presenter

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
References
- Clayden EC. Practical section cutting and staining. Edinburgh: Churchill Livingstone, 1971.
- Hopwood D. Fixation and fixatives. In Bancroft J and Stevens A eds. Theory and practice of histological techniques. New York: Churchill Livingstone, 1996.
- Carson FL. Histotechnology. 2nd ed. Chicago: ASCP Press, 2007.
- Winsor L. Tissue processing. In Woods A and Ellis R eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;4.2-1 - 4.2-39.
Leica Biosystems Knowledge Pathway content is subject to the Leica Biosystems website terms of use, available at: Legal Notice. The content, including webinars, training presentations and related materials is intended to provide general information regarding particular subjects of interest to health care professionals and is not intended to be, and should not be construed as, medical, regulatory or legal advice. The views and opinions expressed in any third-party content reflect the personal views and opinions of the speaker(s)/author(s) and do not necessarily represent or reflect the views or opinions of Leica Biosystems, its employees or agents. Any links contained in the content which provides access to third party resources or content is provided for convenience only.
For the use of any product, the applicable product documentation, including information guides, inserts and operation manuals should be consulted.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.