
탈회(Decalcification) 개론

탈회(Decalcification)란 모든 필수 미세 성분들을 보존할 수 있는 양질의 파라핀 절편을 준비하기 위해 뼈나 다른 석회화된 조직으로부터 무기질을 제거하는 기법입니다. 탈회는 표본이 완전히 고정된 이후 보통의 파라핀 처리 전에 시행됩니다. 본문에서는 뼈의 기본 구조를 설명하고 절편을 제작하기 위한 기술적 옵션들을 간략히 소개합니다. 탈회의 절차와 과정의 성공적인 모니터링에 대해 논의하고 시약 선택에 있어 몇 가지 보편적인 옵션들을 제공합니다.
서론
조직학자가 뼈나 다른 석회화 표본에서 절편을 제작해야 하는 경우 선택할 수 있는 옵션이 여러 가지가 있습니다. 기법과 처리 방법을 선택할 때는 수행하고자 하는 검사의 유형을 반드시 고려해야 합니다. 예를 들어 만약에 대사성 뼈 질환을 검사하면서 무기질화 된 뼈를 뼈로부터 분별해야 하는 경우나 형태계량학적 측정이 요구되는 경우, “탈회 되지 않은” 뼈의 절편을 제작함으로써 무기질 함량을 유지하고 관찰해야 할 수 있습니다. 무기질 뼈는 매우 단단한 물질이기 때문에 절편을 만드는 기술의 범위에는 한계가 있습니다. 고정 후 바로 얇은 박판으로 톱질을 한 후 거친 표면을 사용하여 연마해서 얇은 “연마” 절편을 제작할 수 있습니다 (그림 1 참조). 또한, 무기질 뼈와 비슷한 강도를 가지는 아크릴 혹은 에폭시 수지에 뼈 표본을 침윤시켜 제작하는 것도 가능합니다. 그런 다음 침윤된 검체로부터 연마 절편을 제작하거나 강력한 마이크로톰(라이카 SM2500 모델 등)과 탄화텅스텐 혹은 다이아몬드 칼을 사용하여 바로 절편을 제작할 수 있습니다 (그림 2 참조). 무기질 해면골을 냉동 절편 만드는 것 또한 다른 가능한 방법입니다. 1-3

더 일반적으로는 뼈와 다른 석회화 표본을 고정 후 탈회(탈미네랄화) 하고 표준 방법을 사용하여 파라핀 절편을 제작합니다. 탈회된 절편은 골수 검사, 종양이나 감염의 진단, 혹은 다른 용도로 사용된다. 검체는 장골능 골 생검, (대퇴골두와 같은) 수술 중 제거된 뼈 조각, 또는 절단 검체로부터 절제된 형태로 존재할 수 있습니다. 미세 방사선 촬영은 종종 적절한 뼈 검체를 선택하는 것을 돕기 위해 사용됩니다. 뼈를 제외한 다른 조직은 괴사와 같은 퇴행성 과정과 연관되어 석회화가 진행되거나 (비정상 조직의 석회화) 혈관벽, 신장, 폐, 혹은 다른 장기에서 일어날 수 있습니다 (전이석회화).4 만약 조직 검체에서 석회화 된 부분이 상당하다면 검체를 먼저 탈회시키지 않고 충분한 절편을 얻는 것이 불가능할 수도 있습니다. 또 다른 방법은 검체를 처리할 때 칼슘의 존재가 예상되지 않는 곳으로부터 절편을 얻게 하기 위해 파라핀 블록에 “표면 탈회”를 적용하는 것입니다.
탈회의 과정은 비교적 명료하며 조직학 기법의 표준 서적에서 광범위하게 논의됩니다. 1-3 하지만 고품질의 결과를 얻고자 한다면 몇 가지에 주목할 가치가 있습니다.
뼈의 구조
뼈는 제1형 콜라겐 섬유를 함유한 석회화 된 매트릭스로 둘러싸인 세포들 (뼈 세포)로 구성되어 있습니다. 바탕질 내부의 칼슘은 섬유질 원소들 사이에 침작된 수산화인회석 결정[Ca10(PO4)6(OH)2]의 형태로 존재합니다. 이러한 결정들은 탈회 과정 중 용해되는데, 올바르게 수행된 경우, 결합 조직은 치밀 섬유성 결합조직의 물리적 특성을 지닙니다.
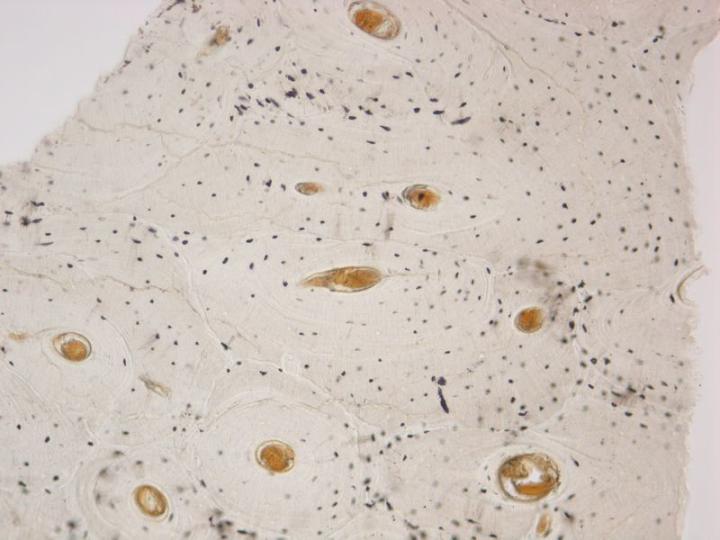
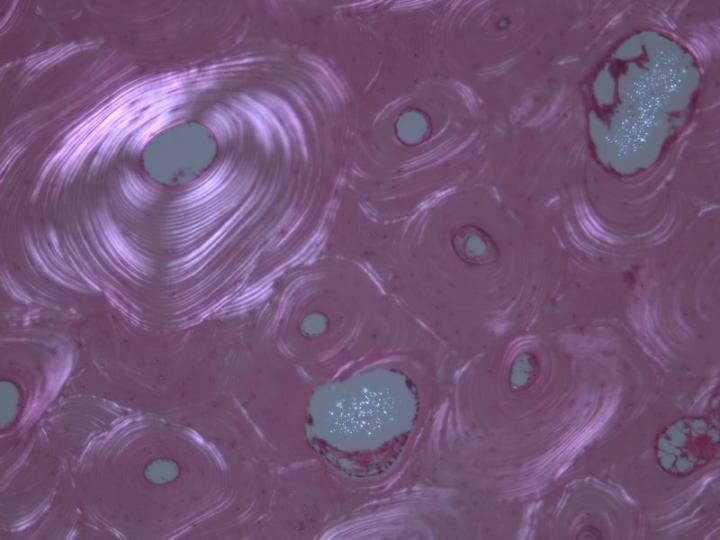
성숙뼈에는 두 가지 유형이 있습니다. 피질골(Cortical bone) 혹은 치밀골은 긴 뼈의 몸통과 두개골의 편평골 중 주요 부분들을 형성하며 뼈단위라 불리는 원통형 구조의 배열을 바탕으로 아주 치밀한 구조를 가지고 있습니다. (그림 3). 갯솜뼈 혹은 해면골은 골수에서 발견되는 뼈 판을 연결하는 얇은 칸막이 (잔기둥)로 구성된 훨씬 더 세밀한 배열을 가지고 있습니다. 이는 척추와 긴 뼈의 뼈 끝에 위치하고 있습니다. (그림 4). 치밀골과 해면골 모두 콜라겐 섬유들이 구조적으로 맞춘 층 혹은 층판에서 발달되며 편광 현미경으로 관찰할 때 특징적인 모습을 보입니다. (그림 5 참조).2-3, 5
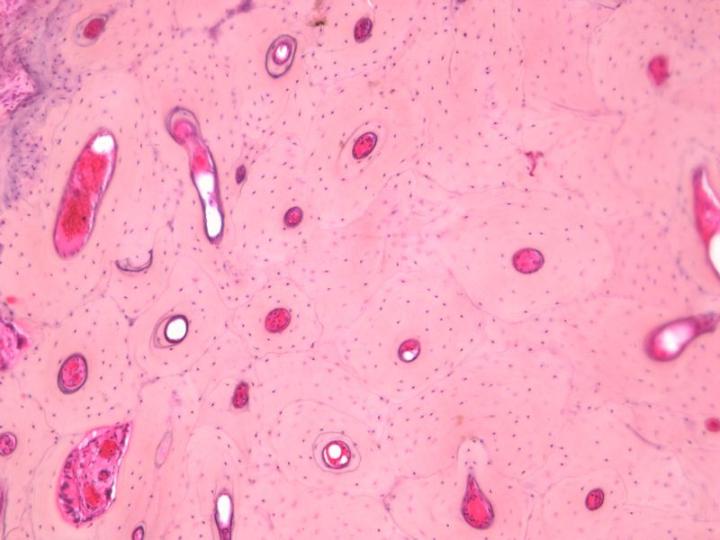
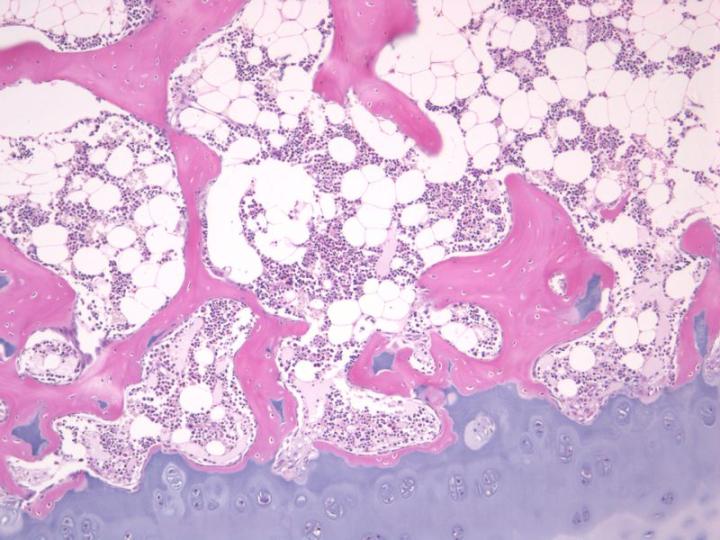
표본 제작을 위해 받은 뼈 검체의 특성을 신중하게 고려하는 것은 중요합니다. 치밀골과 해면골의 상대적인 양이 중요하고 이것이 탈회와 처리 과정에 필요한 시간을 결정하기 때문입니다. 예를 들어 엉덩이뼈 능선 트레파인 생검 검체는 해면뼈의 원주 위에 가로놓인 겉질뼈의 테두리를 포함합니다. 탈회 과정에서 겉질뼈는 마지막으로 칼슘염을 내놓게 될 것이고, 완전히 탈회 되지 않으면 적절한 절편을 얻는 데 어려움을 겪을 것입니다.
뼈의 고정
탈회제로 사용되는 산에 의한 손상으로부터 뼈의 세포 및 섬유 요소들을 보호하기 위해서는 탈회에 앞서 검체들을 철저히 고정하는 것이 특히 중요합니다. 2-3 제대로 고정되지 않은 검체들은 탈회 과정 중 짓물어 이후 염색이 잘 되지 않게 됩니다. 특히 골수를 함유한 부위에서는 매우 뚜렷하게 나타납니다. 그러므로 탈회를 시작하기 전에 관행적으로 뼈 검체 고정 시간을 늘립니다. 고정제가 뼈에 스며들 수 있게 준비하는 것이 중요하므로 피부와 연부 조직은 가능하다면 큰 검체로부터 제거되야 합니다. 뼈 검체는 고정력을 향상시키기 위해 최대한 빨리 얇은 슬라이스로 썰려야 하며 적당한 양의 고정제가 사용되어야 합니다. 뼈 슬라이스를 만드는 데는 고품질의 섬세한 톱니를 가진 톱이 사용되어야 합니다. 굵은 톱은 상당한 기계적 손상을 일으킬 수 있으며 뼈조각을 검체 내에 있는 연부 조직에 밀어 넣을 수도 있습니다 (그림 6 참조).
포르말린 완충 용액은 뼈에 대해 만족스러운 고정제이지만 골수의 보존이 중요한 경우 일부 실험실에서는 아연 포르말린 혼합물, B5, 포르몰 아세틱 알코올 (Davidson 고정제), 또는 보인(Bouin) 용액 등을 대안으로 사용할 수 있습니다.
탈회제 – 강산
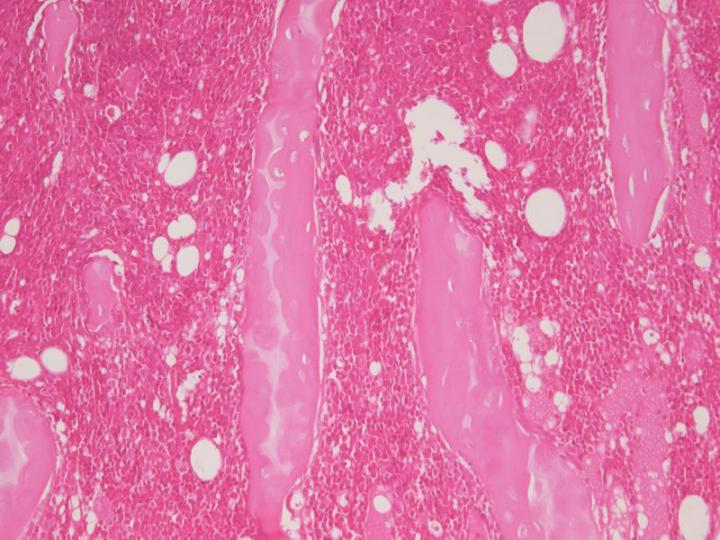
최대 농도 10%의 염산이나 질산과 같은 강산은 가장 빠르게 작용하지만, 과도한 시간 동안 사용하면 빠르게 핵 염색을 손실시키고 조직이 짓무를 수 있습니다. 이러한 시약들에 대한 검체의 노출을 최소화하기 위해 적절한 종말점(end point) 검사를 사용하는 것이 중요합니다. 작용이 빠르다고 하는 상품화된 탈회제들은 일반적으로 강산(가장 흔히 염산) 기반이며, 좋은 결과를 얻기 위해서는 제공된 설명에 주의하여 보수적으로 사용되어야 합니다. 예를 들어, Surgipath의 Decalcifier II® 는 작용이 빠르고 염산을 함유하고 있다면, 그림 7은 적절한 종말점을 넘어 무기물 산 탈회제로 계속하여 처리하였을 때의 결과를 보여줍니다.
표1은 일반적인 무기물 산 기반 탈회제 몇 가지를 나열한 것입니다. 더 포괄적인 리스트를 위해서 조직검사학 표준 교과서 참고 부탁드립니다.
표 1: 무기물 산 탈회제
|
탈회제 |
공식 |
비고 |
|
질산6 |
증류수 내 5% |
빠른 작용, 종말점 넘을 시 염색 손상 발생. |
|
Perenyi 용액6 (1882) |
10% 염산 40ml 0.5% 크롬산 30ml 순 알코올 30ml |
질산 용액보다 더 천천히 탈회시키는 전통적인 탈회제. 작용이 꽤 빠르며, 종말점을 넘을 시 염색 손상 발생. |
|
염산3 |
증류수 내 5-10% |
비스-클로로메틸에테르 (발암물질)의 형성을 피하기 위해 검체를 염산에 넣기 전에 검체에서 포르말린을 세척해야 한다. 빠른 작용, 종말점 넘을 시 염색 손상 발생. |
|
Von Ebner 용액6 |
염화나트륨 포화 용액 50ml 증류수 42ml 염산 8ml |
빠른 작용, 종말점 넘을 시 염색 손상 발생. |
탈회제 – 약산
포름산과 같은 약산은 인기가 많고 탈회를 위해 많이 사용됩니다. 포름산은 간단하게 10% 수용액 또는 포르말린이나 완충액과 혼합하여 사용할 수 있습니다. 강산 제제들보다 느리지만, 더 가볍게 작용하며 핵 염색을 간섭할 가능성이 적습니다. 1, 7 포름산에 기반한 상품화된 탈회제의 예로는 Surgipath’s Decalcifier I®가 있다. 이것은 포르말린도 함유하고 있어, 탈회 뿐 아니라 고정도 잘하며 순조롭게 작용한다고 알려지고 있습니다. 삼염화 아세트산 (trichloracetic acid, TCA) 과 같은 다른 산들도 사용됩니다. 피크르산 (picric acid)은 몇몇 고정제의 성분으로써 약한 탈회 특성을 가지고 있습니다.
표 2: 약산 탈회제
탈회제 – 킬레이트 제제
에틸렌다이아민태트라아세트산 (ethylenediaminetetracetic acid, EDTA)과 같은 킬레이트 제제는 아파타이트 (apatite) 결정의 표면에서 칼슘 이온을 포착하여 천천히 그 크기를 줄임으로써 작용합니다. 이 과정은 매우 느리지만 매우 순조롭게 진행되기 때문에 (검체의 크기에 따라 몇 주가 소요될 수도 있다), 이러한 제제는 급한 검체는 적절하지 않지만, 고품질의 형태학이 요구되거나
IHC
,
FISH
, 또는 PCR과 같은 기법을 위해 특정 분자 원소를 보존하여야 하는 연구 목적의 경우에 적합합니다.91,10 EDTA가 탈회하는 속도는 pH 의존적이며, 보통 pH 7.0에서 사용됩니다. pH 10에서는 더 빠르게 작용하지만, 일부 조직 성분들은 알칼리 pH 농도에서 손상될 수 있습니다. 10
표 3: 킬레이트 탈회제
|
탈회제 |
공식 |
비고 |
|
중성 EDTA1 |
EDTA 디소듐염 250g 증류수 1750ml 수산화나트륨을 첨가하여 (약 25g 필요) pH 7.0 설정 |
천천히 작용하지만, 조직 손상이 적음. 일반적인 염색들은 대부분 영향 없음. |
탈회 속도에 영향을 미치는 요소들
농도
활성제의 농도는 칼슘이 제거되는 속도에 영향을 미칩니다. 공개되어 있는 탈회 용액의 공식들은 속도와 조직 손상의 정도 사이에 균형을 이룹니다. 활성제는 칼슘과 결합하면서 농도가 떨어져 고갈될 것이므로 충분한 용량을 사용하고 탈회 과정 중 여러 번 보충해주는 것이 좋다는 것을 기억해야 합니다.
온도
높은 온도는 탈회 속도를 빠르게 하지만 조직 손상도 증가시키기 때문에 굉장히 주의 깊게 다루어야 합니다.
교반
가벼운 교반은 속도를 조금 높일 수 있습니다.1
접근성
고정과정과 마찬가지로 새로운 탈회제가 검체의 모든 표면에 즉시 접근할 수 있어야 합니다. 이는 검체 안으로의 확산과 침윤을 향상시키고 용액, 이온화, 칼슘 제거를 용이하게 합니다.
탈회의 효율성을 높이는 기타 기술
EDTA와 함께 초음파 처리를 하는 것은 이후 분자 분석을 위한 트레파인 검체의 탈회를 가속화하기 위해 성공적으로 사용되고 있습니다. 이 과정에서 온도는 세심하게 조절되어야 합니다. 9 마이크로파 처리는 염산 탈회제와 함께 사용되고 있지만 높아진 온도는 형태를 손상시키고 인공부산물을 야기할 수 있기 때문입니다.10 이온 교환 수지는 일부 탈회 프로토콜에 포함되어 있으며, 탈회제를 담고 있는 용기에 첨가되어 산의 효과를 유지하는 이온화된 칼슘들을 흡수합니다. 만약 산성 탈회제가 적절한 용량으로 사용되고 정기적으로 교체되는 경우라면 이러한 수지를 사용할 필요는 아마도 없을 것입니다.3 뼈를 산 탈회제에 넣고 전류가 적용되는 전극을 연결하는 전해 탈회는 검체에 열 손상을 일으킬 가능성 때문에 널리 사용되고 있지 않은 기술입니다.3
탈회의 종말점 결정
높은 품질의 결과를 얻기 위해서는 모든 칼슘이 제거되는 시점을 결정하는 것이 중요합니다. 왜냐하면 이 시점부터는 조직 손상이 증가하는 속도로 발생하기 때문입니다. 과도한 탈회는 (특히 강산 탈회제의 경우) 세포핵과 같은 호염기성 요소들의 염색을 망치고 일부 상황에서는 연부 조직 성분들을 짓무르게 할 수 있습니다. 반면에 불완전하게 탈회된 표본들은 절편을 제작하기 어렵거나 불가능할 수 있습니다.
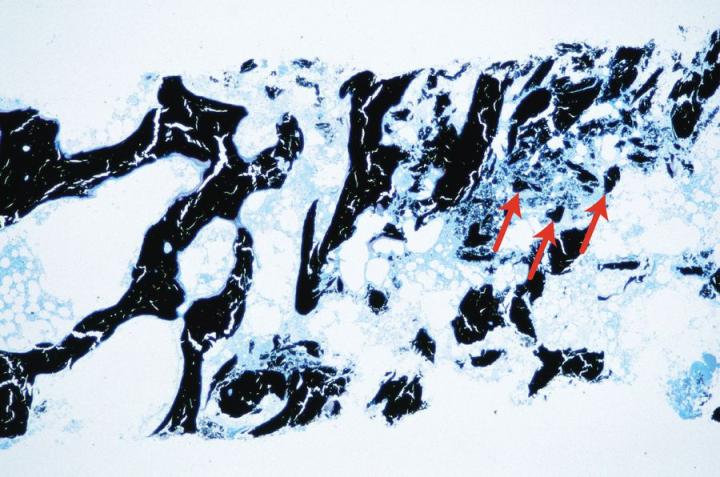
가장 좋은 방법은 (특히 대퇴골두와 같은 큰 검체의 경우) 검체를 엑스레이(X선) 촬영하는 것이다. 좋은 품질의 X선은 미세한 잔류 칼슘 침착물을 드러내 보이고 필요한 경우 추가적인 처치를 하는 것입니다. 이 과정은 대퇴골두와 같은 큰 검체들의 탈회 과정을 따르는 훌륭한 방법입니다 (그림 8 참조). 일부 산성 탈회제를 사용하는 경우 (특히 포름산) 간단한 화학 검사를 적용할 수 있습니다. 옥살산 암모늄 용액은 수산화암모늄으로 중화시켜 탈회의 최종 샘플에 첨가됩니다1 만약 칼슘이 존재하면 옥살산 칼슘 침착물이 형성되어 아마 탈회가 불완전하고 더 긴 시간이 탈회에 필요하다는 것을 나타내게 됩니다. 물론 이러한 검사는 탈회제의 비교적 최근 변화에 대해 (예를 들어 조직에 한 시간만 노출된 경우) 가장 잘 시행됩니다. 물리적 검사는 남은 석회화된 부분을 “감지” 위해 검체를 구부리고, 탐색하고, 다듬는 조작이 필요합니다. 이 방법은 전문적인 사람이 한다면 성공적일 수 있겠지만, 일반적으로 신뢰할 수 없는 방법으로 간주됩니다. 구부리거나 탐색하는 동안 검체에 물리적 손상이 일어날 수 있고 작은 칼슘 침착물은 쉽게 놓칠 수 있습니다. 7 검체를 헹구고 블롯팅한 후 조심히 무게를 재어 종말점을 결정하는 방법 또한 기술되어 있습니다. 이는 큰 검체에서 효과적일 수 있습니다.10
만약 당신이 탈회의 종말점이 다가왔다고 믿고 과정을 천천히 하여 과도한 탈회와 그에 따른 조직 손상을 피하고 싶다면 (당신의 실험실이 주말에 비어 있어 관리할 수 없는 경우와 같이) 검체를 탈회제에서 꺼내어 헹군 뒤 포르말린에 다시 넣어 놓을 수 있습니다 (염산이 사용되었을 경우 중요하다). 이후 편할 때 탈회를 재개할 수 있습니다.10 다른 대안으로 검체를 탈회제 안에 든 채로 4˚C에 냉장시켜 과정의 속도를 늦출 수 있습니다.1
탈회 후 및 조직처리 전 조치
수돗물에서의 광범위한 세척이나 알칼리성 용액의 적용 등을 포함하여 처리 전 남아있는 산을 중화하기 위한 다양한 방법들이 공개되어 있습니다. 일반적으로 남아있는 산은 처리 중에 제거될 것이기 때문에 수돗물에서의 짧고 효과적인 세척만으로도 충분합니다.1 처리 시약과 산 처리기를 오염시키는 것을 피하기 위해 탈회제의 대부분을 제거하는 것이 중요합니다.
탈회 된 뼈와 다른 탈회 된 조직에 적합한 스케줄 선택
무기물이 제거되면 표준 처리 스케줄을 사용할 수 있습니다. 완전한 탈회에도 불구하고 뼈는 (특히 치밀뼈는) 철저한 처리가 필요한 치밀한 부위를 포함하고 있다는 것을 명심해야 합니다. 너무 짧은 스케줄보다는 긴 스케줄을 적용하는 것이 낫습니다. 선택은 검체의 특성과 크기에 따라 달라질 것입니다. 왁스 침투 시 진공을 적용하는 것은 완성된 블록의 품질을 향상시킬 것입니다.
표면 탈회
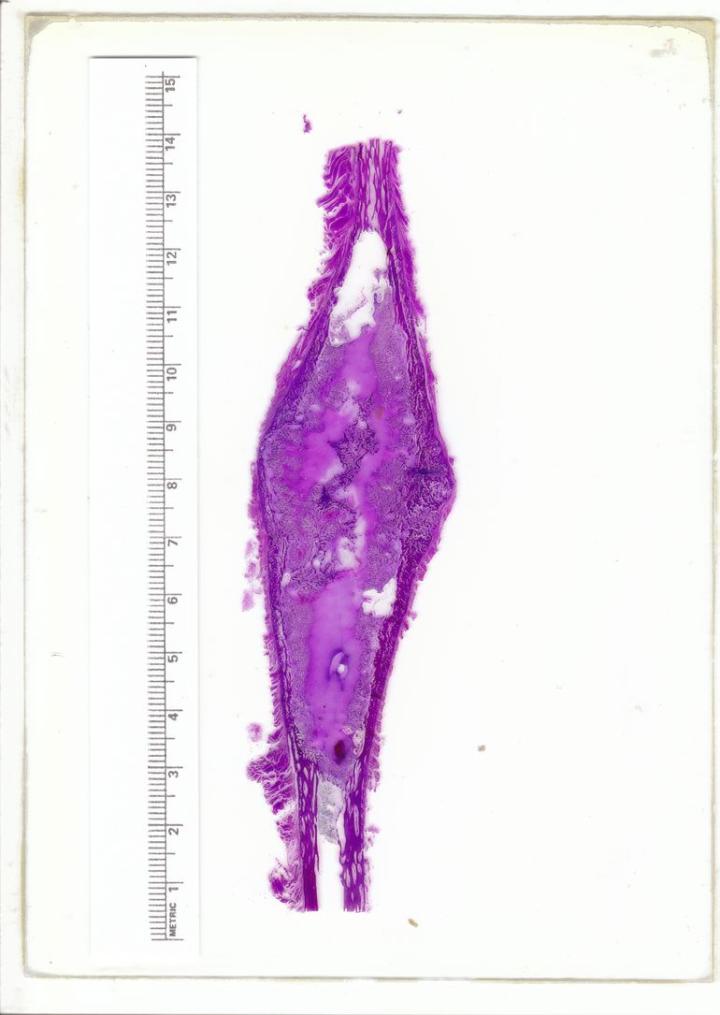
이 방법은 파라핀 블록에 나타날 수 있는 작은 예상치 못한 칼슘 침착물을 처리하는 방법입니다 (그림 10 참조). 보통 칼슘이 발견되는 것은 검체를 노출시키기 위해 마이크로톰에서 블록을 다듬은 이후 과정입니다. 조직이 노출된 후에는 마이크로톰에서 블록을 제거하고 산 탈회제에 15~60분간 노출된 면이 아래로 가게 놓아둘 수 있습니다. 이러한 표면 처치는 탈회제가 블록 안으로 짧은 거리 침투하여 칼슘을 용해하게 합니다. 그 다음 블록을 물에 꼼꼼히 헹구어 남아있는 산을 제거하고, 냉장한 후 절편으로 만들 수 있습니다. 탈회제는 블록안으로 아주 짧은 거리만 침투하여서 오직 몇 개의 절편만을 만들 수 있기 때문에 신중한 블록의 재배열이 필요합니다.1, 11

결론
탈회는 간단한 과정이지만 성공적으로 시행되려면 다음과 같은 검토가 필요하다.
- 검체에 대한 신중한 예비 평가
- 철저한 고정
- 고정 및 처리를 위한 적절한 두께의 슬라이스 준비
- 적합한 탈회제의 선택과 적절한 용량의 사용 및 정기적인 교체
- 종말점의 신중한 결정
- 적절한 실험 스케줄을 이용한 철저한 처리
발표자 소개

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
참조 문헌
- Page KM. Bone. In Bancroft JD and Stevens A eds. Theory and Practice of Histological Techniques. New York: Churchill Livingstone, 1996.
- Moore RJ. Bone. In Woods AE and Ellis RC eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;7.2-10.
- Carson FL. Histotechnology. 2nd ed. Chicago: ASCP Press, 2007.
- Vardaxis NJ. Pathology for the health sciences. Melbourne: Macmillan Australia Pty Ltd, 1997.
- Young B, Heath JW. Wheater's Functional Histology. 4th ed. Edinburgh: Churchill Livingstone, 2000.
- Clayden EC. Practical section cutting and staining. Edinburgh: Churchill Livingstone, 1971.
- Skinner RA, Hickmon SG, Lumpkin CK, Aronson J, Nicholas RW. Decalcified Bone: Twenty Years of Successful Specimen Management. The Journal of Histotechnology 1997;20;267-277.
- Wallington EA. Histological Methods for Bone. London: Butterworths, 1972.
- Reineke T, Jenni B, Abdou MT et al. Ultrasonic Decalcification Offers New Perspectives for Rapid FISH , DNA, and RT_PCR Ananlysis in Bone Marrow Trephines Am J Surgical Pathology 2006;30.
- Callis G, Sterchi D. Decalcification of Bone: Literature Review and Practical Study of Various Decalcifying Agents, Methods, and Their Effects on Bone Histology. The Journal of Histotechnology 1998;21;49-58.
- Rolls GO. Difficult Blocks and Reprocessing. Leica Microsystems, 2011.
Related Content
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.



