
一般染色および特殊染色の手引き


通常のHE染色と特殊染色は、組織ベースの診断や研究で重要な役割を果たします。透明な組織切片を着色することにより、高度に訓練された病理医や研究者は、これらの染色により、顕微鏡で組織の形態(構造)を観察したり、特定の細胞タイプ、構造、または細菌などの微生物に関しても、それらの存在やその頻度を探索することができます。
組織病理学研究室では、「一般染色」とは、ヘマトキシリンおよびエオシン染色(HE)を指します。この染色法は、すべての組織標本で、根底にある組織の構造と状態を明らかにするために「日常的に」使用されます。「特殊染色」は、病理医や研究者が必要とするすべての情報をHEでは入手できない場合に使用される、多数の代替染色技術を指すために長い間使用されてきた用語になります。
染色のための組織の調製
組織を染色して観察する前に、組織を調製し、非常に薄い切片、すなわち1細胞の厚さに薄切して顕微鏡のスライドにのせられるようにする必要があります。組織を固定し(腐敗しないように)、次に硬化させて保持し、必要とされる非常に薄い切片(通常2〜7 µm)に薄切できるようにします。このために使用される2つの主な手法があり、凍結切片とパラフィン包埋切片と呼ばれています。
凍結切片 は、通常、外科医が腫瘍を切除する際、手術中に切除マージンを知る必要があり、早く回答が必要な場合に使用されます。凍結切片は、すぐに作成できますが、通常、パラフィン技術と同等の切片品質にはなりません。凍結切片作製のプロセスは次のとおりです:
- 組織を急速に凍結し、保存および硬化します。
- 凍結組織をクリオスタット (凍結チャンバー内のセクショニングミクロトーム) 内で切片にし、染色のために顕微鏡のスライドにのせます。
- 切片を、形態が崩れ始める前に、直ちに固定し、その後染色します。
パラフィン切片を準備する場合は、標本をまず固定液で保存し、次にパラフィンを標本に浸透させることにより組織構造をサポートします。このプロセスは、凍結切片を作成するよりも時間がかかりますが、ほとんどの場合、染色の品質はより良く、結果として得られるサンプル(ブロックと呼ばれます)はほぼ無期限に保存できます。パラフィン切片作製のプロセスは次のとおりです:
- 固定 により組織を保護する(通常 ホルムアルデヒド・ベースの溶液)。
- 切り出し で切片にする組織の特定の領域を単離する。
- 組織処理 では、一連の試薬を使用して、水性(水ベース)環境を疎水環境に置き換えます。これにより組織成分にパラフィンが浸透できるようになります。
- 包埋 により標本の向きが決まり、切片薄切と保存のために標本をパラフィンのブロック内に包埋します。
- 切片作製は ミクロトーム 上で行い、非常に薄い切片を薄切し、ウォーターバスで浮かせて取り出し、顕微鏡のスライドに載せます。
- 次に、スライドをオーブンまたはホットプレートで乾燥させて水分を除き、組織をスライドに付着させます。
- スライド上の組織はこの時点で染色が可能です。
- 最初の染色ステップは脱パラフィンで、染色前に溶媒を使用してスライドからパラフィンを除去します。これは常に染色プロセスの一部として行われます。染色が完了すると、切片をカバーガラスで覆います。これで、標本が永久的なものになります。

HE染色が日常的に使われるのはなぜか
ヘマトキシリン・エオジン(HE)染色は組織病理学研究室で日常的に使用されています。その理由は、病理医/研究者に非常に詳細な組織像を提供するからです。細胞質、核、小器官、細胞外成分などの細胞構造を明瞭に染色することによりこれが達成されます。この情報は、多くの場合、細胞の組織化(または組織崩壊)に起因する疾患の診断を可能にするのに十分であり、実際の細胞の異常や特定の指標(癌で典型的に見られる核変化など)も示します。IHC/ISH染色を使用する場合でも、HE染色は診断画像の重要な部分を形成しています。というのは、HE染色により根底にある組織の形態が分かるので、病理医/研究者がIHC/ISH染色を正しく解釈することができるからです。
臨床組織学検査室では、すべての標本は最初にHEで染色され、特殊染色またはIHC/ISH染色は、より詳細な分析のために追加の情報が必要な場合にのみ指示されます。たとえば、2つの形態学的に類似した癌のタイプを区別する場合などです。
必要とされるHE染色の量が多いので、ほとんどの臨床検査室では完全自動化システムを使用しており、手作業による染色は現在ほとんど行われていません。
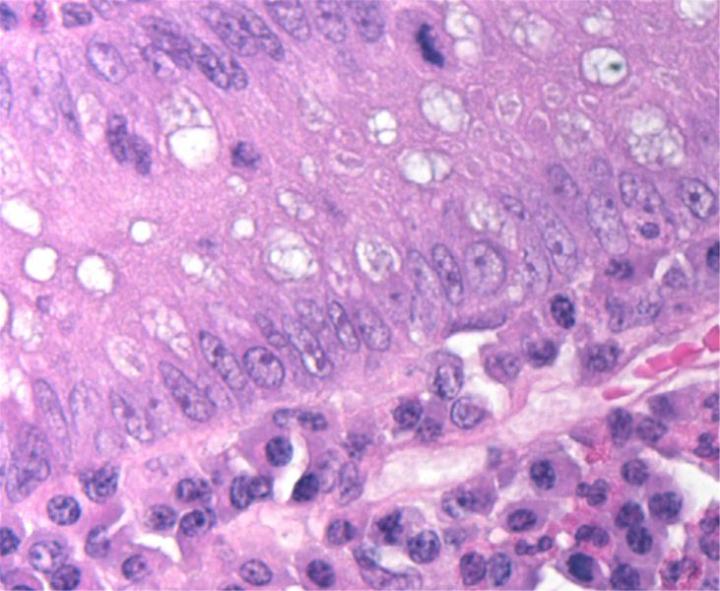

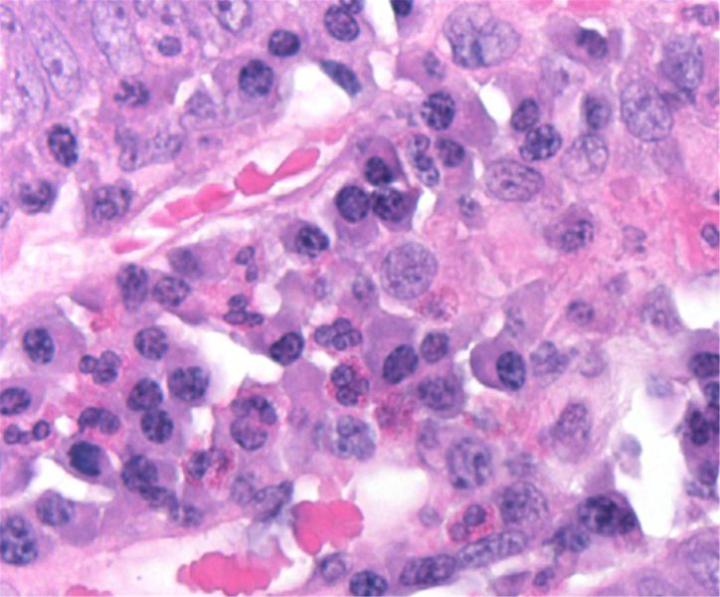

HEの化学
HE染色は2つの色素、ヘマトキシリンとエオジンを使用します。これらの色素は異なる組織成分を染色するので、この組み合わせが使用されます。
ヘマトキシリンは、 塩基性 色素のように反応し、紫がかった青色です。酸性または好塩基性の構造、例えば、細胞核(DNAと核タンパク質など)や、RNAを含む細胞小器官であるリボソームや粗面小胞体などを染色します。
エオジンは 酸性 色素で、通常は赤みがかったピンク色です。塩基性または好酸性の構造、例えば、細胞質、細胞壁、細胞外繊維などを染色します。
色素の起源
ヘマトキシリンは、ログウッドの木から抽出され、精製されます。次に、酸化させ、媒染剤(通常はアルミニウム)と結合させて、細胞構造に結合できるようにします。組織学的検査で使用されている多くのヘマトキシリン製品のうち、ギルのヘマトキシリン、ハリスのヘマトキシリン、マイヤーのヘマトキシリンが最もよく使用されます。
エオジンは、臭素と蛍光色素との反応によって形成されます。組織学的検査では一般的に2種類のエオシンが使用されます。わずかに黄色がかったエオジンYとわずかに青みがかったエオジンBです。エオジンYが最もよく使用されます。


特殊染色液
特殊染色という用語は、伝統的にはHE以外の染色を指していました。さまざまな方法が含まれていて、HE染色では同定されない、特定の組織構造、成分や微生物を可視化するために使用されます。
他の染色法としては、特定のタンパク質やDNA/RNA配列を標的とした 免疫組織化学的検査 やin-situハイブリダイゼーションが用いられます。これらの方法を「特殊染色」ファミリーのメンバーに含めることもありました。しかし、方法や目的がまったく異なるので、現在では、「IHC/ISH染色」と呼ばれる、3番目のカテゴリに分類されるのが普通です。
あらゆる目的のために文字通り何百種類もの特殊染色がありますが、臨床組織学的検査で常に使用されているものは少ししかありません。この染色の多様性のため、特殊染色はHE染色ほど自動化されていません。多くの大規模な検査室は自動免疫染色装置 を一般的な染色に使用しますが、まだ手で染色する領域も残っています。一部の染色の複雑さも、自動免疫染色装置使用の妨げになっています。
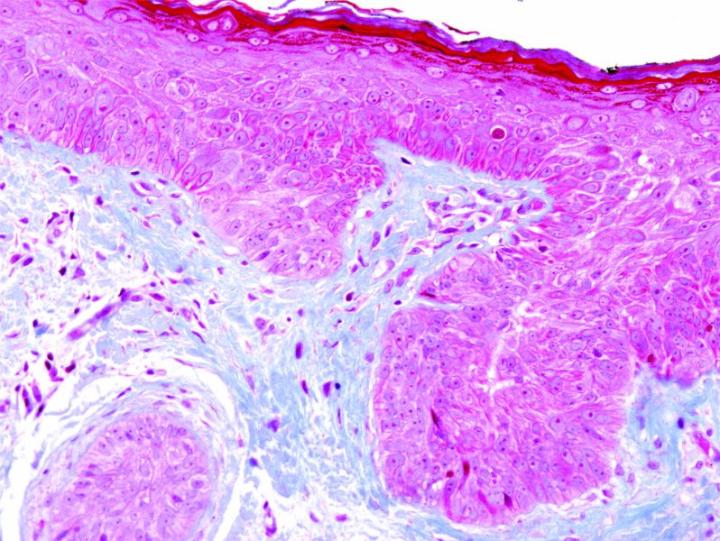
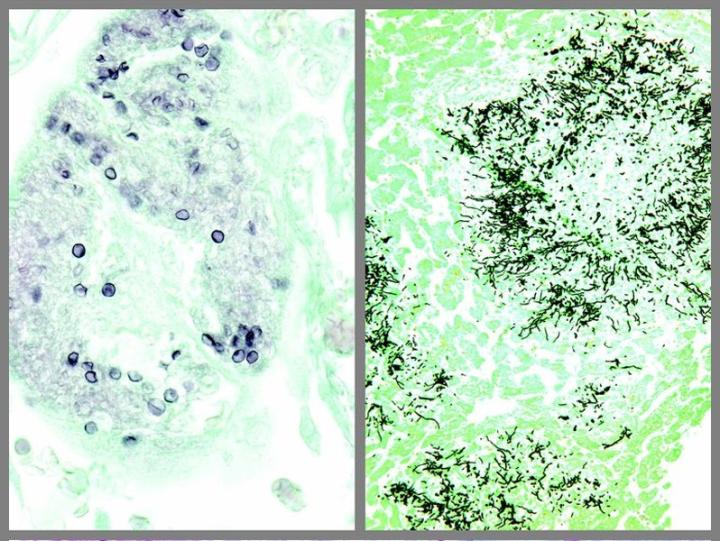
よく使用されるいくつかの特殊染色
以下の画像は、いくつかの一般的な特殊染色とその用途を示しています。
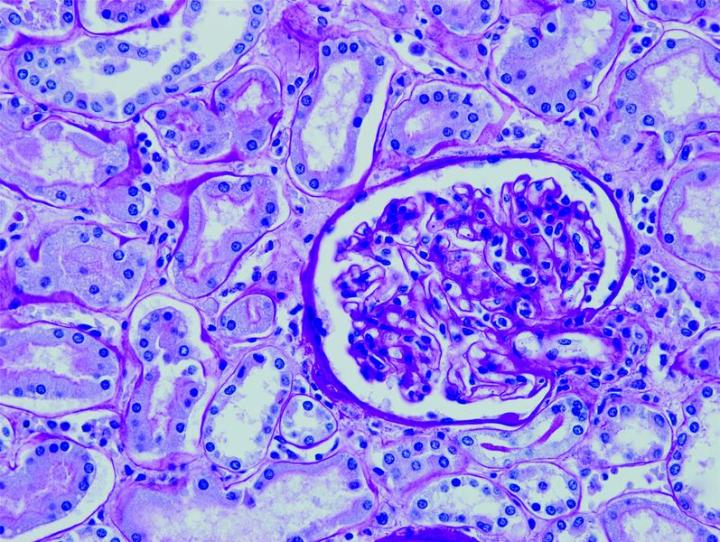


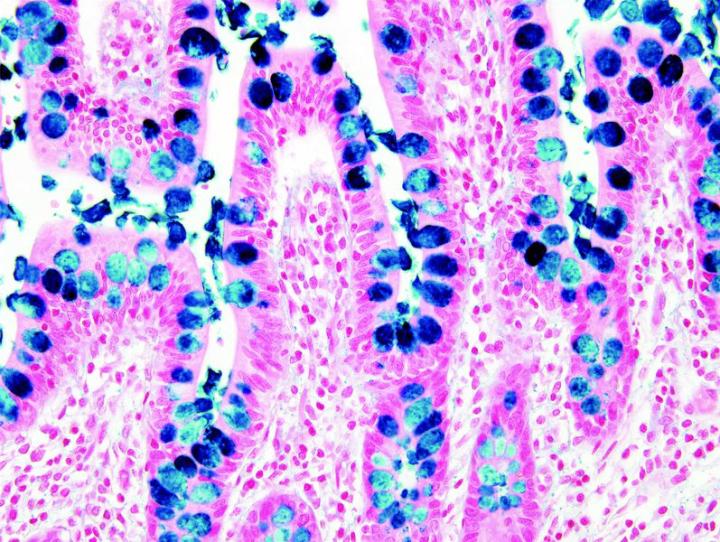
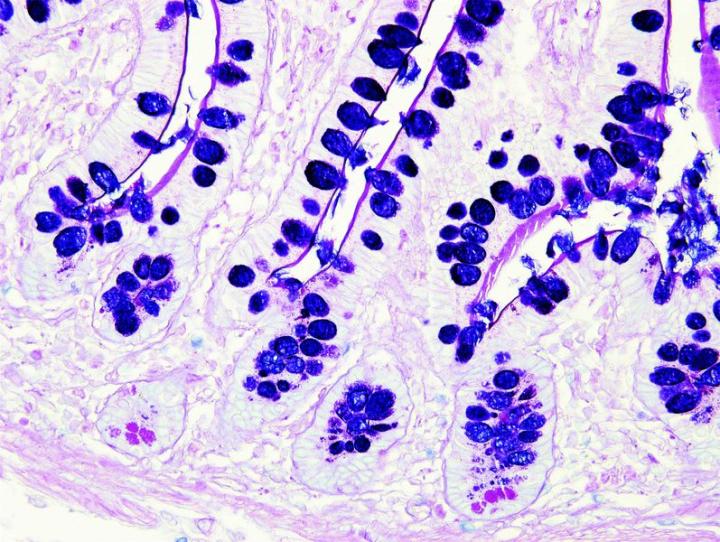
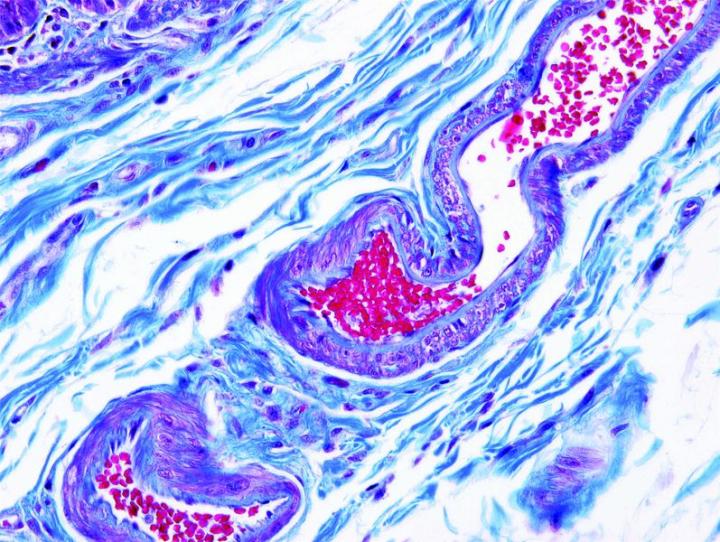

よりよい特殊染色へのステップ
ライカバイオシステムズのビジョンは、がん診断を進歩させ、生活を改善することです。このビジョンを実現する1つの方法は、染色品質の向上を支援することです。 IHC と ISH の品質は染色試薬から生じるものではないと認識しているため、このシリーズでは染色品質のさまざまな側面を検討し、将来の検査が診断の改善にどのように影響するかを検討します。
ステップ64 - 染色を理解する
その染色をすることで何を示そうとしているのかを理解してください。
ただ「方法に従う」だけで、完成した切片中に何が見えなければならないかが明確に分かっていないと、悪い結果につながります。

ステップ65 – ポジティブコントロールの使用
示そうとしている構造/物質を含むことがわかっているコントロールスライドを常に使用してください。
「染色しようとした構造/物質がスライド中に見えない場合は、存在していないと考えます。」

ステップ66 - 正確な時間で行う
ステップ66 - 正確な時間で行ってください。
時間が常におおよその場合。時間が不正確だと、一貫性のない結果になります。

ステップ67 - 試薬の安定性を考慮する
使用している試薬の 保存期間 に注意してください。一部の試薬や色素溶液は劣化するのに時間がかかりますが、他の試薬や色素溶液は非常に不安定であり、用時調整してすぐに使用する必要があります。使用前にと酸化(熟化)させるために、しばらく放置する必要がある試薬もあります。
私たちは すべての試薬は無期限に使用できると想定しています。

ステップ68 - 試薬を正しく保管する
試薬を正しく保管してください。試薬の中には真菌やカビの成長を促す傾向があるものもありますので、その場合は冷蔵保存が必要になります。光に敏感なものは、暗所での保管が必要です。
「試薬はすべて染色ベンチの上の棚に保管しています。時折、切片に浮遊生物が見られることがあります。」

ステップ69 - 方法を着実に実行する
プロトコルに正確に従ってください。
同じプロトコルを使用していると思われるのに、スタッフメンバーにより結果が異なります。

ステップ70 - 変更をすべて記録する
使用している方法から逸脱した際にはすべてを記録してください。
結果がよくない場合に、プロトコルの変更が記録されていないと、原因を解明することが困難または不可能な場合があります。

ステップ71 - 洗浄ステップを標準化する
洗浄手順には特に注意してください。結果の変動原因となることが多いので、できるだけ標準化してください。
研究室のスタッフはさまざまな洗浄技術を使用しています。激しく攪拌をする人もいれば、軽く攪拌する人もいます。

ステップ72 - 顕微鏡を慎重にセットアップする
分化段階などの重要な段階では顕微鏡制御を使用してください。カバーグラスのない(ウェット)切片の見え方に及ぼす顕微鏡セットアップの影響に注意してください。偽のバックグラウンド染色が見えてしまう場合があります。
すべての方法に関して、染色レベルを肉眼でスライドを見ることにより評価します。
About the presenters

James Anderson is a Global Marketing Manager at Leica Biosystems with experience with histology and scientific, technical, and marketing communications.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
Leica Biosystems Knowledge Pathway content is subject to the Leica Biosystems website terms of use, available at: Legal Notice. The content, including webinars, training presentations and related materials is intended to provide general information regarding particular subjects of interest to health care professionals and is not intended to be, and should not be construed as, medical, regulatory or legal advice. The views and opinions expressed in any third-party content reflect the personal views and opinions of the speaker(s)/author(s) and do not necessarily represent or reflect the views or opinions of Leica Biosystems, its employees or agents. Any links contained in the content which provides access to third party resources or content is provided for convenience only.
For the use of any product, the applicable product documentation, including information guides, inserts and operation manuals should be consulted.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.