
HE染色の概要:ベストプラクティスへの手引き


日常的な診断では、病理医が細胞や組織構造の詳細を見るためにヘマトキシリンとエオシン(HE)が多く使用されています。多くの場合、病理医の学習経験と個人的好みによって、染色強度が異なります。HE染色は、細胞質、核、および細胞外マトリックスの特徴を幅広く示すため、ほとんどすべての教育テキストにHE画像が掲載されています。私たちは、一世紀以上変わっていない、シンプルで現在も不可欠なこの染色を使い続けています。
HEの染色手順は、基本的なプロトコールに従っています:
- 脱パラフィン
- 脱水
- ヘマトキシリン
- 分別
- ブルーイング
- エオシン
- 脱水
- 透徹
- 封入
このように形式が整っているので容易に再現できます。また、試薬は復元力があるため、試薬交換が必要になるまで、多数のスライドを同じように染色できます。
以前は、染色液とその成分は、検査室で日常的に調製されていました。市販の既製試薬は珍しく、高価でした。したがって、経済的にHEを行う方法として、技術者は必要に応じて染色液を作る方法を学びました。問題は、染色の品質が変わらないことを確認することでした。さまざまな技術者が独自のアプローチを用いた方法に従っているため、染色液の調製は通常1人に任されていました。とは言え、検査室には多くの技術者がいるため、試薬の準備に必要な時間はチームの全体的な作業量を損なうことはありませんでした。
多くの検査室では、市販の染色液を使用することが、安定した再現可能な染色の品質を確保する最も簡単な方法であると考えています。ヘマトキシリンとエオシン両方の染色液の多種多様な組み合わせにより、ごくわずかな手間で目的の結果をカスタマイズできます。より多くの技術者が退職し、企業がスリム化されると、人員配置の減少のために市販試薬を使用することが理想的になってきます。技術者が、検査室の最も自動化が進んでない領域である包埋と薄切に集中できるようになるからです。
組織学的検査の分野に参入する新しい専門家にとって、試薬を作る時代は急速に過去のものになりつつあります。私はこの変化は問題ではないかと思います。その主な理由は、組織学的検査の特徴である技術の一部が失われるからです。生徒と一緒に作業するときの私の個人的な課題の1つは、生徒の染色トラブルの解決をサポートすることです。検査室で染色液を作る時に、ある成分が欠けている場合や不適切に混合物が追加されたときに何が起こるかを、チームは実際の経験から学びます。これらの変化は、染色されたスライドを微妙に変化させる可能性があり、組織学的検査チームがこれらの変化を最終的に修正することが期待されています。結局のところ、新しい組織学的検査チームは、試薬を調製した経験やその過程で学んだ知識がないので、簡単に修正できる微妙な変化を解決するのに苦労する可能性があります。
HE染色に含まれるものは何か?
ヘマトキシリン・エオシン染色は、 凍結切片、穿刺吸引細胞診、パラフィン固定包埋組織など、組織学検査室の多くの領域で使用されています。どうすればスライドをうまく染色できるかについてよりよく理解するためには、染色液の構成成分を理解することが重要です。
ヘマトキシリンは、細胞内の核の詳細を示すために使用されます。発色の深さは、核内のDNA量だけでなく、サンプルがヘマトキシリン中に置かれた時間の長さにも関連しています。
ヘマトキシリンは無理なく簡単に調製できる染色液です。色素自体はHematoxylon campechianumの木から抽出されます。ヘマトキシリンの酸化によりヘマテイン(正電荷)が生成されまれ、これが実際にHE染色に使用される色素となります。媒染剤の添加により、ヘマテインが組織の陰イオン(負電荷)成分に付着する能力が向上します。

ヘマトキシリンは通常、染色前に使用する媒染剤によって分類されます。媒染剤は、ヘマテインの正イオン電荷を増強します。これは、ヘマテインが、陰イオン電荷組織成分(通常はクロマチン)へ結合することを助けます。媒染剤の種類は、染色された成分の最終的な色にも影響します。日常の組織学で使用される最も一般的な媒染剤は、硫酸アンモニウムアルミニウム(アンモニウムミョウバン)です。この媒染剤により、核の色が赤になり、その後、サンプルを弱塩基性溶液ですすぐと、より馴染みのある青に変わります。
マイヤーヘマトキシリンは、ミョウバンヘマトキシリンで、一般的に使用され、進行性染色と退行性染色の両方に使用できます。特殊染色や免疫組織化学的検査での核の対比染色としてよく使用されます。これらの染色では、マイヤーを使用して核を染色し、分別剤を使用せずに青色にします。マイヤーは水性の染色液です。
ハリスヘマトキシリンは、一般的に使用される別のミョウバンヘマトキシリンで、細胞診標本の進行性染色に使用される場合がありますが、組織学的検査では進行性染色、退行性染色のいずれにも使用できます。この染色は明確な核の詳細を示すのに役立ちます。ハリスを使用する際の1つの課題は、より一般的に使用される塩酸ベースの分別剤とは対照的に、弱酸で最も良く分別されることです。ハリスはアルコールベースの染色剤です。ギルヘマトキシリンは硫酸アンモニウムのヘマトキシリンです。進行性染色または退行性染色として使用でき、さまざまな濃度で利用できます。水とエチレングリコールで作られているため、染色剤の自動酸化が通常数か月にわたって防止され、ハリスヘマトキシリンよりも安定しています。ただし、ギルの性質上、核外染色が発生する場合があります。ムチンやスライドに使用されている粘着性物質までも、ギルで強く染色されてしまう可能性があります。
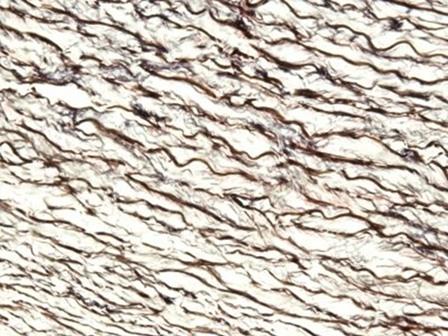
媒染剤として鉄塩を使用するヘマトキシリンは、通常、特殊染色に使用されます。これは、ミエリンやエラスチン繊維など、ミョウバンヘマトキシリンより多くの組織構造を明示することができるためです。最もよく知られているものの1つは、エラスチカワンギーソン染色(Verhoeff-Van Gieson染色)で使用されているワイゲルト鉄ヘマトキシリンで、この画像に示されています。
核の染色について概説しましたので、細胞質成分用の色素について説明しましょう。エオシンは、細胞質と細胞核を区別する最も一般的な対比染色です。一般的にはピンク色で、結合組織繊維の種類に応じてピンクの濃淡が異なります。
エオシンYは、エオシンの中で最も一般的に使用されている形態で、水とアルコールの両方で使用することができます。また、少量の酢酸を加えることで、エオシンの染色も鮮明になります。エオシンにフロキシンを添加すると、HE染色で見られる赤が増強されます。したがって、赤をより鮮やかに示したい場合は、フロキシンを追加してもかまいません。
多くの検査室では、市販の染色液を使用することが、安定した再現可能な染色の品質を確保する最も簡単な方法であると考えています。ヘマトキシリンとエオシン両方の染色液の多種多様な組み合わせにより、ごくわずかな手間で目的の結果をカスタマイズできます。より多くの技術者が退職し、企業がスリム化されると、人員配置の減少のために市販試薬を使用することが理想的になってきます。技術者が、検査室の最も自動化が進んでない領域である包埋と薄切に集中できるようになるからです。
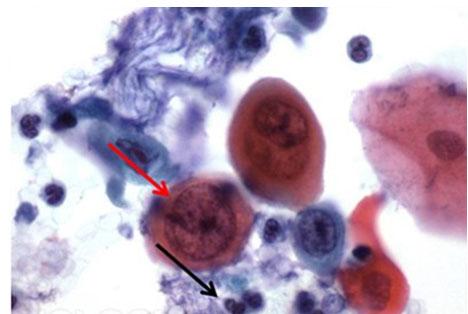
EA50やEA65など、他のエオシン混合物も時々使用されます。これらの染色は主に細胞診に使用されるもので、エオシンYに加えて、ライトグリーン、黄みがかった色、ビスマルクブラウンなどがあります。これらの2つの色素を加えることで、淡い青からピンクまで、細胞質の色が変化します。これは、PAPスメアの扁平上皮細胞で最も顕著です。この混合物の濃度により、50または65と名付けられます。
染色を分別することで、観察者の好みに合わせて組織から染色を選択的に除去することができます。ヘマトキシリンの場合、塩酸(迅速な分別のため)および酢酸(よりゆっくりとした制御された分別のため)が最も一般的に使用されます。歴史的には、塩酸(HCl)が標準でしたが、より穏やかな酢酸が色素を穏やかに除去するために使用されています。この傾向の一部は、自動染色の利用が原因になっています。自動染色では、試薬で処理する時間に加えて、ロボットアームの動きに対応する必要があるからです。
Scott's Tap Waterなどの青味剤を使用して、ヘマトキシリンを赤から、期待されている従来の青色に変更します。これらのわずかに塩基性の溶液は、色素を化学的に変化させて色を変化させます。一部の場所では、水道水に十分なミネラルが含まれているため、pHによって水が塩基性になり、ブルーイングするために特定の試薬を使用することなく核をブルーイングできます。しかし、ほとんどの場合、ラボでは通常、適切なブルーイングを確実にするために、このステップを追加します。
これらのコンポーネントは、組み合わされて、組織学的検査室で最も使用される標準的な染色液を構成します。
HE染色プロトコールの選択
良好な染色を得るための次のステップは、どのタイプのHE染色が望ましいかを決定することです。通常、HE染色には、進行性、修飾進行性、退行性というの3つのタイプがあります。
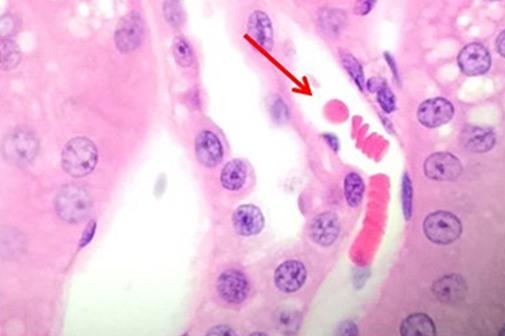
進行性染色は、分別剤による過剰な色素除去をせずに、ヘマトキシリンを組織に加えたときに、時間に応じて染色されます。分別のステップがないため、特に帯電または処理されたスライドでバックグラウンド染色が発生する可能性があります。ムチンなどの非細胞性物質がヘマトキシリンで染色されるため、病理学者がこのタイプの染色を好む場合もあります。この細胞外染色は、十分に分別された腫瘍の指標となります。
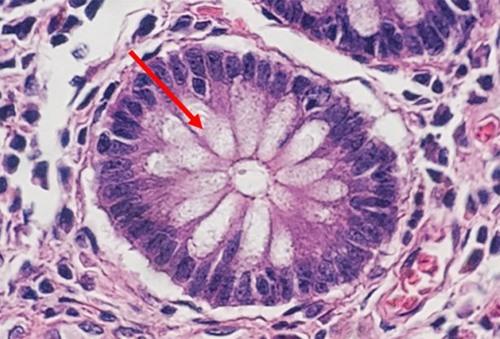
このプロトコールは、単純な退行性染色で、核染色と細胞質染色のバランスが良好です。このプロトコールは、弱酸の分別剤を念頭に置いて設計されています。
染色試薬を選択したら、ベースラインプロトコールから開始することが良いでしょう。そこから、ヘマトキシリンを30秒刻みで変更するか、エオシンを15秒刻みで変更します。エオシンははるかに速く染色される傾向があることを覚えておいてください。エオシン染色強度を大幅に強くする必要がない限り、増分は短い方が最適です。また、一度に1つの染色剤だけを交換することも重要です。エオシンだけをより濃くする必要がある場合でも、ヘマトキシリンが過剰染色されているように見えてしまうことがあります。
検査室が大きくなるにつれて、一貫性のある結果を出すことと継続的なスループットが必要です。再現性は、検査室の染色品質の重要な部分です。手作業で染色する場合、作業者ごとに、染色された各スライドラックの見え方が前回とは異なる場合があります。自動化を導入することにより、不整合の可能性が排除されるだけでなく、検査室で技術者が他のタスクを実行できるようになります。
色素の適切なバランスが達成されることが重要です。エオシンで過染色するとヘマトキシリンが実際よりも赤みがかかって見えるのと同じように、ヘマトキシリンで過染色すると、エオシンにヘマトキシリンが共染し、エオシンの染色が不十分だと錯覚する可能性があります。したがって、染色を最適化するときは、1つの成分の時間のみを変更するようにしてください。この方法は、染色を調整するために無駄な時間を費やす必要をなくすのに役立ちます。
| キシレン | 2 分 |
| キシレン | 2 分 |
| 100%エタノール | 2 分 |
| 100%エタノール | 2 分 |
| 95%エタノール | 2 分 |
| 水で洗浄 | 2 分 |
| ヘマトキシリン | 3 分 |
| 水で洗浄 | 1 分 |
| 分別剤(弱酸) | 1 分 |
| 水で洗浄 | 1 分 |
| Bluing | 1 分 |
| 水で洗浄 | 1 分 |
| 95%エタノール | 1 分 |
| エオシン | 45 秒 |
| 95%エタノール | 1 分 |
| 100%エタノール | 1 分 |
| 100%エタノール | 1 分 |
| キシレン | 2 分 |
| キシレン | 2 分 |
| カバースリップ |
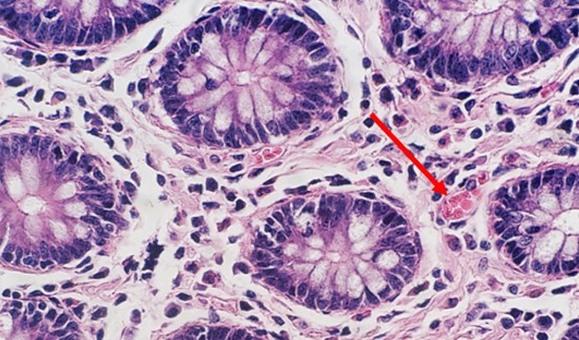
退行性染色および修飾進行性染色では、分別剤が使用されます。分別剤が組織内で作成される場合、弱すぎたり強すぎたりする可能性があります。どちらの場合も染色に影響します。分別剤が意図したよりも強い場合、より多くのヘマトキシリンが除去され、核が薄くなります。時間も重要です。適切に調製された分別剤でも、時間が長すぎると、より多くのヘマトキシリンが除去され、最終的には核の染色が薄くなります。
弱酸性はヘマトキシリンの保存可能期間に関係してきます。弱酸性でなければ、脱パラフィン後の洗浄の水道水のアルカリ性がpHを上昇させ、それにより、色素レーキが沈殿し、色がチェリーレッドからパープルレッドに変わる可能性があります。ヘマトキシリンに少量の酢酸を定期的に追加することは、適切なpHを維持するのに役立ち、染色剤の使用期間を延ばすことができます。
エオシンの分別剤として水が使用されます。エオシンステップの後は、95%エタノールが普通です。エタノールはスライドのすすぎを助け、水は組織から過剰なエオシンを除去します。このステップは、色付けを調節するのに役立ちます。95%エタノールの時間を長くすると、染色が薄くなります。時間を短くすると、鮮やかな色合いが維持されます。しかし、脱水不良によるキシレン中の過剰な水分は、分別を継続させる可能性があり、 封入 後もスライド上のピンクのもやとして見える可能性があります。
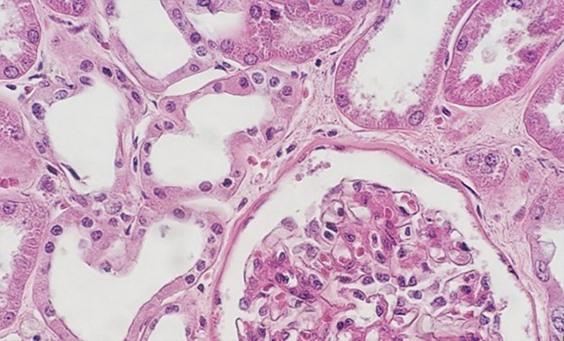
すべての組織が同等に作製されるわけではありません。嚢胞と脂肪質のサンプルは、正しく処理された場合でも、スライドが染色されると、肉眼で見ることが非常に困難な場合があります。これらのサンプルには、多くの場合、細胞内に液体や脂肪が存在するオープンスペースがあり、この組織タイプの特有の着色のアーティファクトがある場合、細胞膜が薄いので明るい外観を与える可能性があります。
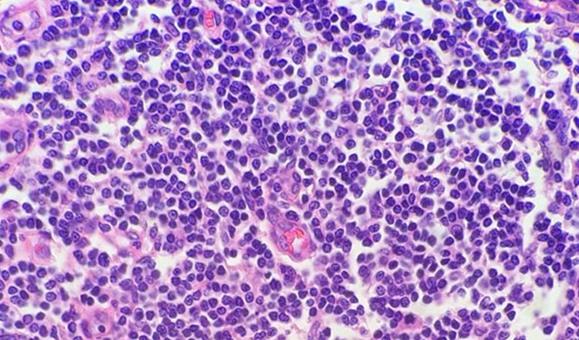
細胞が密集しているサンプル(例、扁桃腺、リンパ節)には懸念点があります。リンパ球は細胞質がほとんどなく、他の組織のように細胞間に細胞物質がほとんどないことに注意してください。このため、ヘマトキシリンはエオシンと競合する必要はありません。細胞がコンパクトな性質を持つ場合もDNAを濃縮され、密集した細胞組織が過剰染色されているように見えますが、単に切片をより薄く作製する必要があるだけかもしれません。
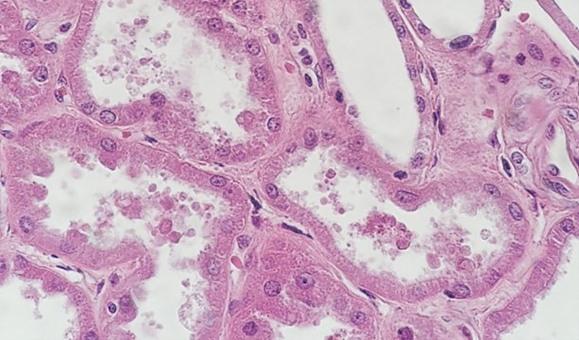
色素を添加する前にスライドからパラフィンを除去するには、清潔で新鮮な脱パラフィン試薬を使用することが不可欠です。キシレンは最も一般的に使用される溶剤ですが、キシレン代替品は危険性が低く、環境に優しいと考えられているため、人気が高まっています。溶媒中の水(試薬の汚染や高湿度環境が原因でも)は、パラフィンを除去する溶媒の能力を低下させます。残っているパラフィンは、色素が組織に浸透するのを阻害し、その結果、画像が不均一になります。
これを防ぐ最も簡単な方法は、試薬をより頻繁に交換することです。少量の乾燥剤ペレット(試薬容器あたり大さじ1杯分)を加えることによっても、溶媒内の水の汚染が減少します。これらの対策は、キシレン代替品を使用する場合、特に重要です。というのは、キシレン代替品はキシレンよりも水の汚染に対する耐性がはるかに低い傾向があるためです。
ヘマトキシリン・エオシン染色(HE)は、組織検査室および組織病理検査室で最も広く使用されている染色です。HE染色は、適切に実行された場合、さまざまな正常および異常な細胞・組織成分を明示する能力を有しパラフィンまたは凍結切片で比較的簡単に実施できる染色です。組織病理検査では、経験豊富な病理学者がHE染色のみを使用して診断できる症例は多いです。
少数のスライドは、手作業で効果的に染色できますが、スループットが高い検査室では、自動染色機によって、一貫性がありかつ良好な染色ができます。
一般的に多くの異なるヘマトキシリン・エオシン染色液が使用されており、それぞれに利点と欠点があります。独自の染色液を調製することを好む検査室もあれば、すぐに使用できる市販の染色液を選ぶ検査室もあります。
はじめに
HE染色は、臓器と組織の微細構造の包括的な描像を提供します。ヘマトキシリンはヘテロクロマチンや核小体を含む核成分を正確に染色し、エオシンは コラーゲン線維や弾性繊維 などの細胞質成分、筋繊維および赤血球を染色します。高品質のHE染色では、色素、特にエオシンによって生成される色の濃淡に微妙な違いがあり、これが疾患に関連する形態学的変化の検出と解釈に役立ちます。
HE染色を実施し、品質を評価するにあたり、染色の微妙さを認識し、高品質の試薬で染色を適切に実施した場合に何が達成できるかを知り、顕微鏡で何を探すべきかを理解していることが重要です。一貫した高品質のHE染色を維持することは、病理組織検査室の基本的な要件です。
次のセクションでは、HE染色を実行する際の基本的な手順を概説します。
パラフィンの除去
パラフィン切片は、疎水性で水性試薬に対して不浸透性のパラフィンワックスが、すべての成分に浸透しています。細胞や組織の成分の大部分は自然な色を持たず、目に見えません。HE染色実施の最初のステップは、すべてのパラフィンをキシレン(炭化水素溶媒)で溶解して除去することです。
切片の水和
完全な脱パラフィン後、数個のアルコール槽にスライドを通してキシレンを除去し、次に水で十分にすすぎます。これで切片は水和され、水性試薬が細胞・組織成分に容易に浸透できるようになります。
ヘマトキシリンの核染色への適用
スライドを、この時点で、ハリスヘマトキシリンなどの核染色剤で染色します。ハリスヘマトキシリンは、溶液中の色素(酸化ヘマトキシリンすなわちヘマテイン)と媒染剤または結合剤(アルミニウム塩)からなっています。最初は、核と他のいくつかの成分が赤紫色に染まります。
「ブルーイング」による核染色の完了
水道水で水洗後、弱アルカリ性溶液で処理することにより切片を「ブルーイング」します。このステップは、ヘマトキシリンを濃い青色に変換します。切片を水洗後、核が適切に染色されているかどうか、適切なコントラストを示しているかどうかを確認して、バックグラウンドの染色レベルを評価します。
過剰なバックグラウンド染色の除去(分別)
ハリスヘマトキシリンを使用する場合は通常、非特異的なバックグラウンド染色を除去してコントラストを向上させるために、分別(脱染色)ステップが必要です。弱酸アルコールを使用します。この処理の後、ブルーイングと水洗が再度必要です。脱染色すなわち分別ステップを含む染色法は、「退行性」染色と呼ばれます。
エオシン対比染色の適用
切片はここで、エオシンの水溶液またはアルコール溶液で染色されます(個人の好みによります)。これにより、核以外の成分の多くがさまざまな色調のピンクで色付けされます。
水洗、脱水、透徹、封入(カバーグラスの適用)
エオシン染色に続き、数個のアルコール槽にスライドを通して、水を完全に除去します。次に数個のキシレン槽ですすいで組織を「透徹」し、完全に透明にします。ポリスチレン封入剤を薄く塗布し、その後カバーガラスをかぶせます。染色とその後のすべてのステップが適切に実行された場合、スライドはすべての重要な微視的成分を明示し、長年にわたり変化しません。
HE染色のトラブルシューティング
HE染色は、実施が比較的簡単な染色ですが、良好な染色を妨げる可能性のあるさまざまなアーティファクトがあります。
アーティファクトは、さまざまな原因で生じる可能性があります。
HE(ルーチン)染色を改善するステップと封入
患者から病理学者までの過程で、組織学的検査のために組織標本を作製するには、注意、スキル、および適切な手順が必要です。「より良い組織学的検査のための101のステップ」では、ベストプラクティステクニックと一般的なアーティファクトを回避するための簡単な方法に関する実践的なアドバイスを提供します。
このセクションでは、より良いHE染色+封入のヒントを強調しています。各手順が、良い組織学的検査を行う上での重要な注意喚起となり、好ましくない結果が発生した場合のトラブルシューティングとしても役立つことを願っています。
「より良い組織学的検査のための101のステップ」は
こちらからダウンロードいただけます。
ステップ52‐正確な染色時間
染色プロトコールの各ステップ時間を正確にします。
染色ステップの時間はおおよそであり、「急いでいる場合」いくつかのステップをスキップします。これにより、写真のような一貫性のない結果が得られる可能性があります。

ステップ53‐定期的な品質のモニタリング
C染色の質をモニターするためにコントロールスライドを定期的に染色します。
HE染色にコントロールスライドを使用したことがない場合、染色不良の原因が、試薬の不良、不適切なプロトコール、または固定不良のいずれであるかを判断することが非常に困難になる可能性があります。。
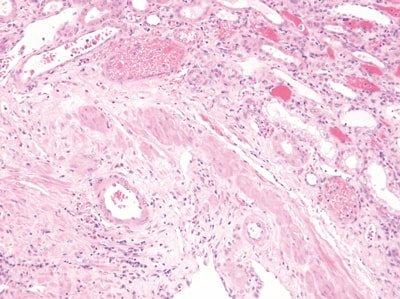
ステップ54‐染色条件の標準化
攪拌、洗浄、排水時間は染色中のすべてのステップが最適化されています
攪拌、洗浄、排水の時間に一貫性がないと、溶媒と試薬はすぐに汚染され染色に一貫性がなくなります。

ステップ55‐完全な脱パラの確認
スライドの脱パラフィンを最適な条件で行います
スライドの脱パラフィンが不完全な場合、スライドには残留パラフィンのパッチが含まれています。これにより、切片に未染色の領域や不均一に染色された領域ができます。
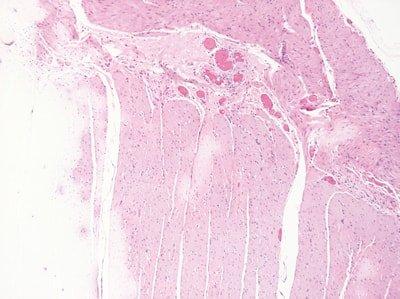
ステップ56‐定期的な試薬の更新
溶媒と染色試薬を、染色したスライドや処理したラックの数に基づいて定期的に交換します。
溶媒と染色試薬の交換は無計画のため、染色の質が低下するまで交換されていません。
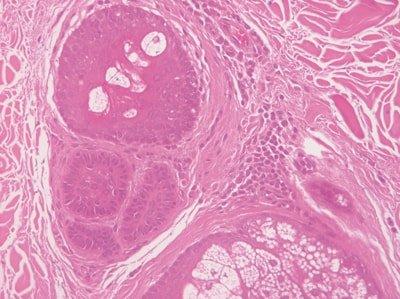
ステップ57‐切片の完全な水和
スライドをヘマトキシリン染色の前に完全に水和します。
ヘマトキシリン溶液は、アルコール、時にはキシレンですぐに汚染され、不均一な染色になります。
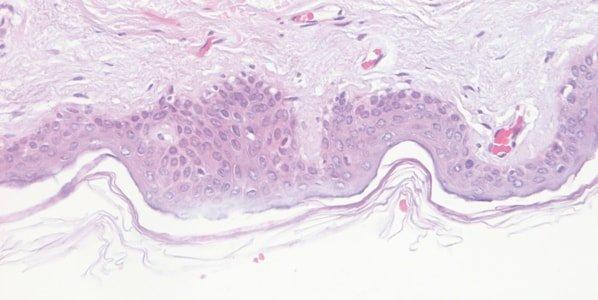
ステップ58‐ヘマトキシリンの品質のモニタリング
ヘマトキシリン溶液のパフォーマンスを注意深くモニターします。使用期間中、ヘマトキシリン溶液はスライドやラックからの持ち込みによって徐々に希釈されるとともに、酸化の影響も受けます。
ヘマトキシリン染色は日々変動します。たとえば、染色槽の表面積、染色中のエアレーションの程度、および周囲の温度等は、染色液の酸化率に影響を与える可能性があります。
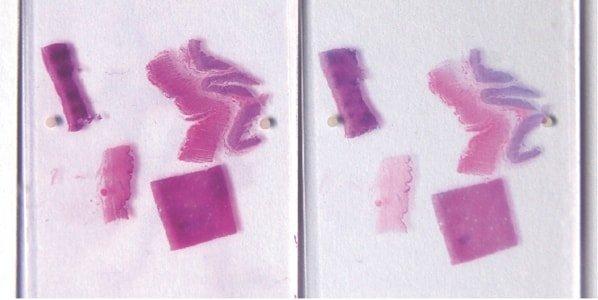
ステップ59‐完全な核の「ブルーイング」の確認
スコットのアルカリ性水道水代替物またはアンモニア水による核の完全な「ブルーイング」を、ヘマトキシリン染色後に常に実行します。この要件は、地元の水道水のpHの影響を受けます。
ヘマトキシリン染色後のアルカリ性水道水中での「ブルーイング」が不完全なため、核がピンク色に見えることがあります。また、ヘマトキシリン染色不足(または過剰分別)およびエオシン過剰染色の核もピンク色に見えます。.
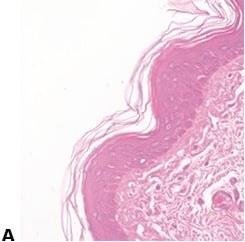
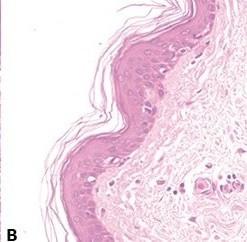
ステップ60‐不均一なエオシン染色の回避
「ブルーイング」後、水道水で徹底的に水洗することにより、エオシンで、弱く不均一な染色を引き起こす可能性がある残留アルカリを除去します。
「ブルーイング」後の水洗不足(残留アルカリを残す)は、エオシン染色を弱く不均一にします。
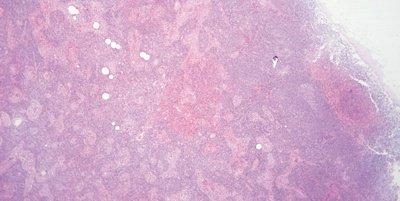
ステップ61‐エオシンのpHのモニタリング
エオシン溶液のpHをモニターします。最適な染色を維持するために、pH 5.0付近を維持します。酢酸を2~3滴添加することでpHを下げることができます。
エオシンのpHをモニターしようとしない。染色強度が低下した場合は溶液を交換します(アルカリ性水道水の持ち込みによりエオシン溶液のpHが上昇することがあります)。
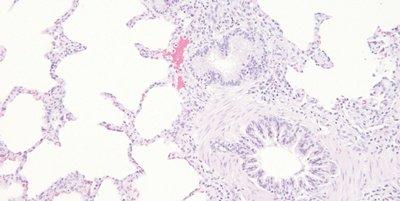
ステップ62‐透徹前の完全脱水および封入
透徹用キシレンに入れる前に、切片を完全に脱水します。
切片は、急いでアルコールに通した状態でキシレンに入れることがあります。水で汚染されたキシレンで透徹すると、組織内に微細な水滴が発生し、鮮明さを欠いた不透明な領域として顕微鏡で観察されることがあります。
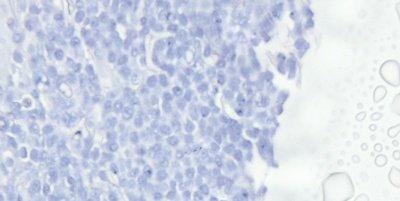
ステップ63‐乾燥と結晶形成の回避
カバーガラスでの封入は、常にスライドが乾燥する前に実施し、高品質の封入剤を使用します。低品質の封入剤の場合、長期間(数カ月または数年)後に結晶が現れることがあるため、使用した封入剤の品質は長期保管後の状態を見れば分かります。
カバーガラスで封入する前に切片を部分的に乾燥させると、一部の核が黒く見えることになります。価格のみに基づいて選択した封入剤は、長期保管中に結晶が発生したり、カバーガラスが持ち上がる場合があります。

About the presenters

Cindy Sampias is a board certified Cyto- and Histo-technologist. With more than 25 years of experience, she is a guest speaker at histology and cytology meetings around the country. She is a technical author for Media Lab, publishing a variety of technical courses and sharing best practices in histology.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
References
この参考文書は、入手可能な文献から編集され、Leica Biosystemsによる医療専門家へのサービスとして提供されています。情報を忠実に報告するためにあらゆる努力を払っておりますが、Leia Biosystemsは、正確性について責任を負うことはできません。この文書は、医学的アドバイスとして、意図したものではなく、また、解釈されるべきではありません。使用にあたっては、それぞれの薬物およびデバイスの製品情報ガイド、添付文書および操作マニュアルを参照してください。Leica Biosystemsと編集者は、この参考文書に記載されている薬物、デバイス、技術、または手順の使用から直接または間接的に生じるいかなる法的責任も負いません。
Related Content
Leica Biosystems Knowledge Pathway content is subject to the Leica Biosystems website terms of use, available at: Legal Notice. The content, including webinars, training presentations and related materials is intended to provide general information regarding particular subjects of interest to health care professionals and is not intended to be, and should not be construed as, medical, regulatory or legal advice. The views and opinions expressed in any third-party content reflect the personal views and opinions of the speaker(s)/author(s) and do not necessarily represent or reflect the views or opinions of Leica Biosystems, its employees or agents. Any links contained in the content which provides access to third party resources or content is provided for convenience only.
For the use of any product, the applicable product documentation, including information guides, inserts and operation manuals should be consulted.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.



