
HEの基礎パート4:HEのトラブルシューティング

HE染色 は、実施が比較的簡単な染色ですが、良好な染色を妨げる可能性のあるさまざまなアーティファクトがあります。アーティファクトは、さまざまな原因で生じる可能性があります。

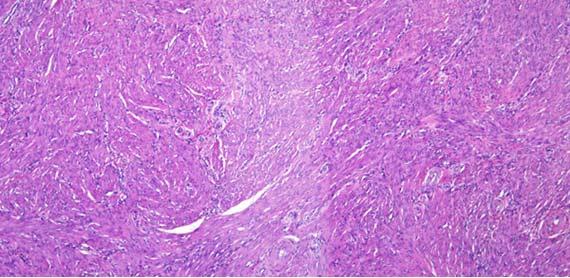

びびりと破裂の切片は、通常、 組織処理に関連しています。びびりは、組織が過剰処理/過剰脱水された結果であり、「破裂」切片は、組織の処理不足/浸潤不足に起因します。組織が過剰処理されていることを示す別の指標は、血管内の赤血球を見ると簡単にわかります。

水は、過剰なエオジンをスライドから穏やかに除去できるため、エオジンの分別剤としてよく使用されます。脱水アルコールと最初の100%アルコールは、エオジンを薄め、エオジンのさらなる分別化を引き起こすのに十分な水を含んでいる可能性があります。「水または希釈アルコール」のステップの回数が多すぎると、エオジンの色合いが薄くなり、細胞質構造の染色が弱くなります。
ステップ間のキャリーオーバーにより、染色中に水がアルコールに入る可能性があります(エオジンの後に)。試薬が定期的に交換されない場合、含水量は増加し続け、カバースリップの前に、後続のキシレンに持ち込んでしまいます。このキシレン中の過剰な水は、時間の経過とともに、組織からエオジンを浸出させる可能性があります。スライドではピンクに見えます。このアーティファクトは、キシレンが水で汚染されているように見えなくても発生する可能性があります。

水がキシレンに入り込むのは、キャリーオーバーだけではありません。周囲の湿度も、キシレンが水で汚染される速度を変化させる可能性があります。
地理的な場所によって、水質はかなり変化します。フッ素化、pH、存在するその他のミネラルは、色素がどのように組織に取り込まれるかや、色素の寿命に影響を与える可能性があります。たとえば ヘマトキシリンは弱酸性であるため、塩基性pHの水道水によって、ヘマトキシリンのpHが上昇し、効果が低下する可能性があります。水道水の水質が悪い場合や変動する場合は、脱イオン(DI)水の使用が最適なオプションです。DIの水圧がプラットフォームステイナーに十分な水圧であることを確認することを忘れないでください。
凍結した組織は、染色が非常に困難なサンプルである可能性があります。計時は非常に重要ですが、病理医が外科スタッフに迅速に対応することができるよう、チームは常に染色時間を短縮することを求められています。とはいえ、染色品質とスピードのバランスを見つけるのが難しい場合があります。
私が経験した最大のアーティファクトの1つは、凍結組織切片作製とは関係のない不均一な染色です。一番の理由は、染色の前にスライドの固定 とすすぎを急いだことです。切片作製中に凍結組織をサポートするために用いられる媒体は水溶性であり、染色前に通常のサンプルからパラフィンを除去するのと同様に、サンプルから除去する必要があることを忘れないでください。この媒体は、パラフィンワックスと同じように染料の浸透も阻害する可能性があります。また、ワックスと同様、染色の最後の時点でスライドに残っている媒体はおそらく見えません。というのは、染色の過程でこの媒体が除去されるためです。

サンプルは通常、検査室のスタッフによって収集されないため、サンプルを収集する担当者の教育が不可欠です。ガーゼパッド、ペーパータオル、先端が綿のアプリケーター、またはその他の媒介デバイスを使用してサンプルを収集すると、単に組織からデバイスに水が移動することで、サンプルが乾燥する可能性があります。このアーティファクトは、特に生検で、同じ収集デバイスを使用して同じ患者から複数のサンプルを収集する場合に最もよく見られます。これらの場合、ホルマリンで収集デバイスをすすぐと患者に害を及ぼす可能性があるため、非多孔性材料を使用してデバイスから組織を除去する必要があります。生理食塩水は、収集したサンプルから水を除去しないので、組織をすすいでデバイスから別の容器に移すためにも使用できます。

適切に固定することを確実にするために、サンプル収集後、直ちに固定液に浸します。ホルマリン は検査室で最も一般的に使用される固定液であり、核の詳細が良く分かります。しかし、ホルマリンは、他の試薬と同様に、特に保管および有効期限に注意する必要があります。ホルマリンを直射日光下に放置すると、溶液のpHが変化し、組織が酸性になる可能性があります。固定液の酸性度は、組織に2つの主要な影響を与える傾向があります:
- 組織外縁のシアリング
- 組織の過剰乾燥
シアリングは、サンプルの外縁が「焼けた」外観を与えるように変化したときに発生します。この変化はまた、サンプルへの試薬の適切な浸透を妨げます。なぜなら、サンプルの外側部分に沿ったタンパク質が障壁を作り、試薬の侵入と水分の排出を妨げるからです。
ティッシュプロセッサー は進化し続けているので、私たちの処理技術も進化させなければなりません。処理の効率化によって患者のニーズを満たすため、プロトコールの処理時間はより合理化されています。このため、すべてのサンプルを同じプロトコールで実行することはもはや合理的ではありません。小さなサンプルを一晩のプロトコールで処理すると、脱水が過剰になり、切片作製が困難になります。浸漬が役立つ場合がありますが、多くの場合、組織に過度の亀裂が生じます。大きなサンプルを、生検により適したプロトコールで処理すると、脱水不足になり、適切な処理が完了するまで切片化される可能性は低くなります。

核のバブリングは、核内のタンパク質が凝固するときに発生します。このアーティファクトは、多くの場合、固定が不十分なサンプルが高温に遭遇した結果です。高いpHの固定液も、バブリングを引き起こす可能性があります。過酷な環境では、タンパク質が小さな液滴の周りで凝固し、シャボン玉のような外観になります。残念ながら、一度発生したこのアーティファクトを除去する方法はありません。

切片作製後、湿ったスライドをオーブンに入れて乾燥させる場合が多いです。高温(70°Cなど)になると、切片の下の水が組織を通して急速に蒸発する可能性があります。この蒸発によりタンパク質が凝固し、シャボン玉のアーティファクトが発生する可能性があります。この場合、バブリングを回避する最良の方法は、オーブンの温度を下げるか、スライドをオーブンに入れる前にスライドを多少風乾させることです。
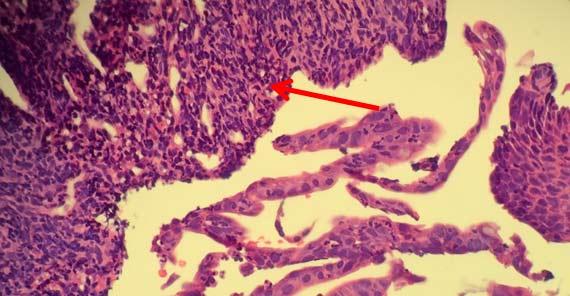
浮遊物は残念ながらあまりにも一般的です。浮遊物の発生源を見極めるための鍵は、それらが組織との関係でスライド上のどこにあるかを確認することです。それらが組織サンプルと同じ焦点面にある場合、おそらくブロック内の汚染物である可能性が高いです(グロッシングまたは包埋のいずれかによる)。
外部汚染(例えば、ウォーターバスや染色試薬内)では、通常、組織の上または組織面の外に浮遊物が見えます。いずれにしても、浮遊物を回避する最良の方法は、清潔なウォーターバスを使用し、グロス/包埋エリアを清潔に保ち、試薬を頻繁に交換またはろ過することです。

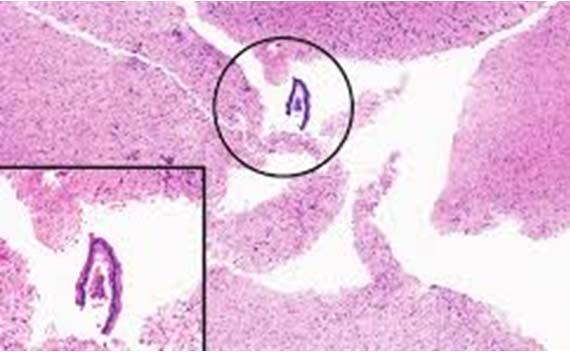
細菌や真菌は、ステイナーや試薬容器を定期的に清掃しないと、これらの内部で増殖する可能性があります。機器のメンテナンスについては、製造元の指示に従ってください。漂白剤はほとんどの場合適切ですが、機器に問題を引き起こす場合があることを覚えておいてください。


色素としてHE染色に現れる可能性のある物質を、人体が生成できること、また実際に生成することを覚えておいてください。メラニン、ヘモジデリン(古い赤血球)、炎症性破片が邪魔になることがあります。固定液であっても、ツェンカーのように、余分な細胞色素を作る場合がありますが、これは病理医がサンプルがホルマリン以外のもので固定されていることを認識していない場合には問題となります。ツェンカー(重クロム酸カリウム/塩化第二水銀)は、その毒性のために主に禁止されていますが、それでも自作しているところは何カ所かあるようです。染色を変化させる可能性のある異常な固定の状況をメモしておいてください。

組織検査室は歴史的にスライドに組織を接着するためにあらゆる種類の技術を使用してきました。以前は、日常的な切片作製に、帯電したスライドは高価すぎると考えられていました。したがって、検査室では、アルブミンや他のタンパク質によって組織をスライドに付着させていました。ウォーターバスへの添加剤として使用できる市販の試薬が入手可能でした(現在も入手可能です)。しかし、課題は一貫性です。各技術者がウォーターバスを満たす方法はそれぞれ異なり、ウォーターバスに添加する接着剤の量もさまざまです。ある人は接着剤を惜しみなく使うかもしれませんが、他の人は少ししか使わないので、バックグラウンド染色を制御するのが難しくなってしまうことがあります。
接着剤にはそれぞれ独自の制限(HEでのバックグラウンド染色など)があり、 免疫組織化学 染色とも干渉する可能性があります。
帯電したスライドは、現在では容易に入手可能で、検査室の染色液でうまく機能するため、接着剤に関連するバックグラウンドやその他の異常が生じる可能性が少なくなっています。すべてのスライドが一貫して扱われるため、スライド間のばらつきは限られています。
帯電した(プラスに)スライドと接着剤の両方がある場合、これらを一緒に使用すると、組織の接着がさらに良くなりますでしょうか?違います!いずれの方法の特性も、組織からイオンを引き付けることです。一緒に使用すると、両方の特性が互いに相殺され、基本的に正に帯電したスライドが、単なる普通のガラススライドに変わってしまいます。
キシレン代替品は現在広く利用可能であり、検査室における安全性を高める可能性があります。それらには、水に対する許容度が低いなど、独自の制限がいくつかあることに注意してください。また、製造元が推奨する互換性のあるマウント媒体を使用する必要がある場合もあります。これは、キシレン代替品のすべてが一般的なキシレンベースのマウント剤と互換性があるわけではないためです。
キシレン代替品は一般に安全ですが、それでもキシレンと同じレベルの注意を払って処理する必要があります。廃棄物処理法は地域によって異なりますが、キシレン代替品は常にキシレンと同じ方法で廃棄し、排水溝に流さないでください。これらの試薬は、環境に良くない炭化水素であることに変わりはありません。またこれらは通常、非常に芳香が強いので、代替品を使用する検査室は、においに対処するために多少の換気が必要になります。
市販されているアルコールの中には、エタノールと同じように染色に有効なものがあります。メタノール、イソプロピルアルコール(IPA)、およびFlexが最も一般的で、検査室にとってはエタノールを使用するよりも費用効果が高くなります。Flexアルコールメーカーは、エタノール、メタノール、IPAをさまざまな混合物で組み合わせているため、含有率(可能な場合)を確認してください。 ステイナーで特定の試薬を使用することに懸念がある場合は、常に互換性の問題について機器の製造元に確認してください。最後に、染色が内部的に検証されていることを確認してください。
HEスライドの見栄えをよくする最も簡単な方法の1つは、試薬を頻繁に交換することです。ほとんどの製造元は、試薬を交換せずに、何枚くらいスライドが処理できるかに関する情報を持っています。このデータはガイドラインですが、あなたの検査室にとってどのような意味があるかを確認してください。試薬を毎日交換するのがよいようなら、毎日交換してください。
今日のほとんどの検査室は、何らかの染色プラットフォームを使用しています。これは、技術者が他のことを行えるようになるだけでなく、一貫性を保つのにも役立ちます。しかし、検査室の他のすべての機器と同様、メンテナンスと品質管理は染色を成功させるために不可欠です。製造元の仕様に従って、ステイナーを清掃し、メンテナンスしてください。
検査室での使用量が多い場合は、メンテナンス作業の間隔を短くすることが適切な場合があります。いずれにせよ、「常に」訓練を受けたエンジニアに機器の機械的な作業を行ってもらってください。ほとんどの企業は、ユーザーがサービスを依頼できるサービスプランを提供しており、通常、予防的な保守管理を予定に入れています。機器に関する資格情報を示さずにサービスを提供しようとする企業に注意してください!外部の業者からのサービスが悪いと、まったくサービスを受けていないのと同じくらい損害を受ける可能性があります。
ここれは簡単なことのように思えますが、機器に関して多くのチームがスタッフのトレーニングにほとんど時間を費やしていないことが現状です。定期的なコンピテンシーチェックを実施し、ウェブセミナーやその他の外部トレーニングを通じてチームメンバーが技術に磨きをかける機会を提供することは、全員が染色の基本を確実に理解するための優れた方法です。
もちろん、最良の染色とは何かについて全員が同意するのは難しい場合があります。染色がどのようなものであっても、病理学者がいくつかのオプションを使用できるように、わずかに異なる時間でいくつかのプロトコールに対応できるようにプログラムすることが最も簡単かもしれません。また、私は簡単なコードシステムを作成して、染色時間が分かるようにしていますが、病理学者は見たものだけに基づいて対応する必要があります。
色合いを調整するときは、シンプルにするのが最善です。多くの場合、次のように調整するとうまく機能します:
- ヘマトキシリン+/-30秒
- エオジンY +/-15秒
通常、一度に1つの調整のみを行うのが有益です。これらの時間は微妙な変更を加えるのに十分です。必要に応じて、より積極的な調整も可能です。ヘマトキシリンが薄すぎる場合は、時間を1分以上増やしてください。ただし、微調整については、上記の時間がうまくいきやすいです。
覚えておいて頂きたいのは、何を見たいかに応じて、ヘマトキシリンまたはエオジンのどちらか一方を調整するだけで、もう一方を鮮やかにしたりまたは薄くしたりできるということです。
この記事の原文は こちら
About the presenter

Cindy Sampias is a board certified Cyto- and Histo-technologist. With more than 25 years of experience, she is a guest speaker at histology and cytology meetings around the country. She is a technical author for Media Lab, publishing a variety of technical courses and sharing best practices in histology.
Related Content
Leica Biosystems Knowledge Pathway content is subject to the Leica Biosystems website terms of use, available at: Legal Notice. The content, including webinars, training presentations and related materials is intended to provide general information regarding particular subjects of interest to health care professionals and is not intended to be, and should not be construed as, medical, regulatory or legal advice. The views and opinions expressed in any third-party content reflect the personal views and opinions of the speaker(s)/author(s) and do not necessarily represent or reflect the views or opinions of Leica Biosystems, its employees or agents. Any links contained in the content which provides access to third party resources or content is provided for convenience only.
For the use of any product, the applicable product documentation, including information guides, inserts and operation manuals should be consulted.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.



