
Una introducción a la descalcificación

La descalcificación describe la técnica para eliminar los minerales del hueso u otro tejido calcificado para poder preparar cortes de parafina de buena calidad que preserven todos los elementos microscópicos esenciales. La descalcificación se lleva a cabo después de que la muestra se haya fijado concienzudamente y antes del procesamiento rutinario en parafina. En este documento se describe la estructura básica del hueso y las opciones técnicas para preparar las secciones. Se analiza el procedimiento de descalcificación y la monitorización correcta del proceso y se proporcionan algunas opciones comunes para la elección de reactivos.
Introducción
Existen varias opciones disponibles cuando el histólogo necesita producir secciones de muestras óseas u otras muestras calcificadas. Al elegir una técnica y un método de procesamiento, se debe tener en cuenta el tipo de investigación que se está llevando a cabo. Por ejemplo, si se está investigando una enfermedad ósea metabólica y es necesario diferenciar el hueso mineralizado del osteoide, o si se necesitan mediciones morfométricas, puede que haya que retener y demostrar el contenido mineral produciendo secciones de hueso no descalcificado. Dado que el hueso mineralizado es un material tan duro, existe una gama limitada de técnicas disponibles para producir secciones a partir de él. Después de la fijación, se puede aserrar directamente en discos finos y luego pulirse utilizando superficies abrasivas para producir secciones finas de “pulidas” (consulte la Figura 1). También es posible preparar muestras óseas infiltrando en ellas resinas acrílicas o epoxi que, cuando se polimerizan, tienen una dureza equivalente a la del hueso mineralizado. Después, puede producir secciones pulidas a partir de las muestras infiltradas o seccionarlas directamente con un microtomo de alta resistencia (como el Leica SM2500) y una cuchilla de carburo de tungsteno o de diamante (consulte la Figura 2). Otra opción son las secciones congeladas de hueso esponjoso mineralizado.1-3

Con mucha más frecuencia, las muestras óseas y otras muestras calcificadas se descalcifican (desmineralizan) tras la fijación y se procesan utilizando un método estándar para producir secciones de parafina. Las secciones descalcificadas se utilizan para examinar la médula ósea y para el diagnóstico de tumores, infecciones u otros fines. Las muestras pueden tener forma de trépano de cresta ilíaca o fragmentos óseos extraídos en el momento de la operación (como cabezas femorales) o diseccionados de las muestras de amputación. Con frecuencia se utilizan radiografías detalladas para facilitar la selección de las muestras óseas adecuadas para el procesamiento. Aparte del hueso, otros tejidos pueden sufrir calcificación asociada a procesos degenerativos como necrosis (calcificación distrófica), o esta puede producirse en las paredes de los vasos sanguíneos o en los riñones, pulmones o cualquier otro lugar (calcificación metastásica).4 Si las áreas calcificadas de las muestras de tejido son sustanciales, puede que sea imposible obtener secciones decentes sin descalcificar primero la muestra. Otra posibilidad es aplicar “descalcificación superficial” a un bloque de parafina para permitir la obtención de secciones en las que no se preveía la presencia de calcio cuando se procesó la muestra.
El procedimiento de descalcificación es relativamente sencillo y se analiza ampliamente en textos estándar de la técnica histológica. 1-3 Sin embargo, si se deben obtener resultados de alta calidad, hay que hacer énfasis en algunos puntos.
Estructura del hueso
El hueso consiste en células (osteocitos) rodeadas por una matriz calcificada que contiene fibras de colágeno tipo 1. En la matriz, el calcio está en forma de cristales de hidroxiapatita [Ca10(PO4)6(OH)2] que se depositan entre los elementos fibrosos. Estos cristales se disuelven durante el proceso de descalcificación que, si se realiza correctamente, deja tejido cohesivo con las características físicas del tejido conjuntivo fibroso denso.
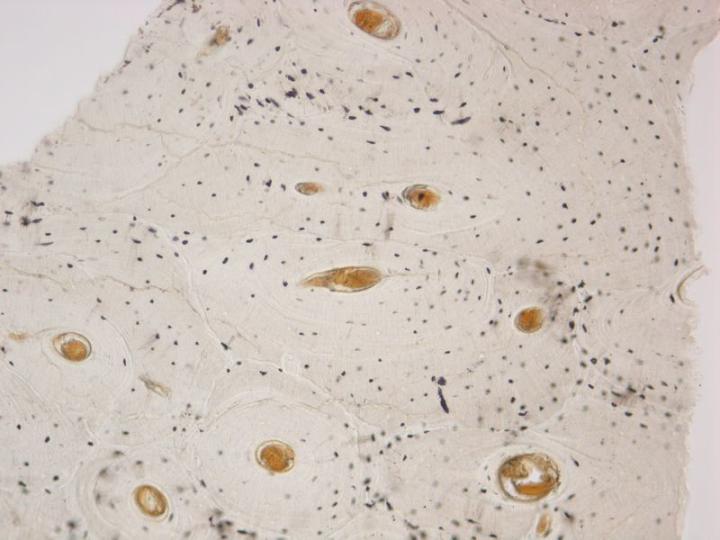
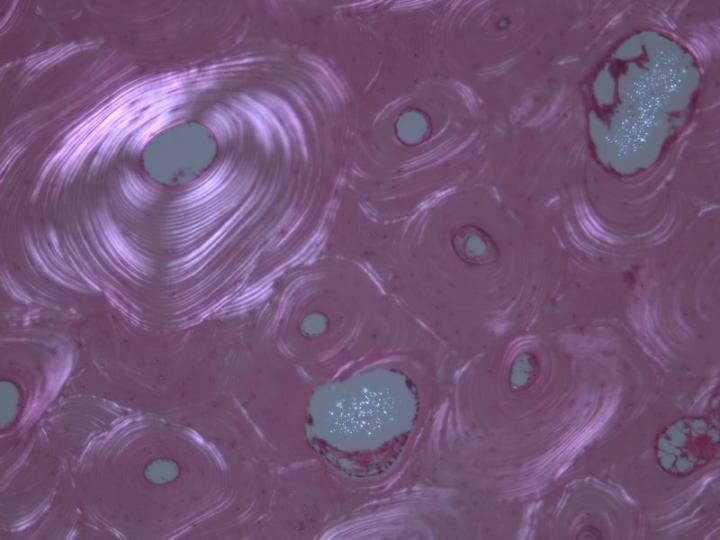
Existen dos tipos de hueso maduro. El hueso cortical o compacto forma la diáfisis de los huesos largos y las partes principales de los huesos planos del cráneo y tiene una estructura muy densa basada en una disposición de estructuras cilíndricas llamadas osteonas (Figura 3). El hueso esponjoso o trabecular tiene una disposición mucho más delicada que consiste en finas particiones (trabéculas) que conectan placas óseas entre las cuales se encuentra la médula ósea. Se encuentran en las vértebras y en las epífisis de los huesos largos (Figura 4). Los huesos compactos y los esponjosos se desarrollan en capas o laminillas en las que las fibras de colágeno están orientadas estructuralmente y muestran una imagen característica bajo microscopía de luz polarizada (consulte la Figura 5).2-3, 5
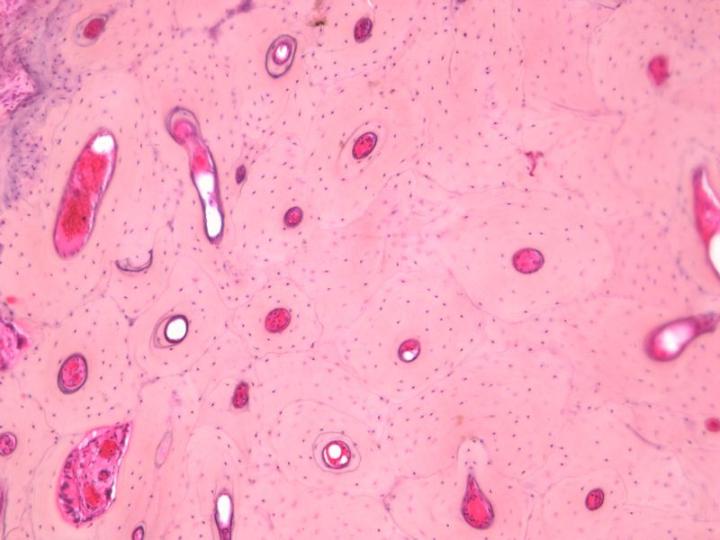
Es importante considerar detenidamente la naturaleza de cualquier muestra ósea recibida para el procesamiento, ya que las cantidades relativas de hueso cortical y esponjoso son importantes y determinarán el tiempo necesario para la descalcificación y el procesamiento. Por ejemplo, la muestra de trépano de cresta ilíaca consta de un borde de hueso cortical superpuesto a un cilindro de hueso esponjoso. El hueso cortical será el último en desprenderse de sus sales de calcio durante la descalcificación y, a menos que esté completamente descalcificado, la obtención de secciones decentes será dificultosa.
Fijación del hueso
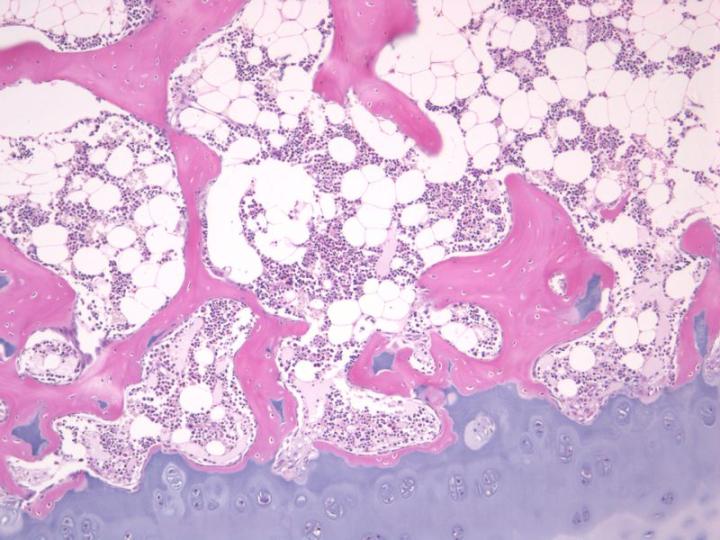
Con el fin de proteger los elementos celulares y fibrosos del hueso del daño causado por los ácidos utilizados como agentes descalcificadores, es particularmente importante fijar bien estas muestras antes de la descalcificación. 2-3 Las muestras mal fijadas se maceran durante la descalcificación y no se tiñen lo suficientemente bien después. Esto es muy evidente en las zonas que contienen médula ósea. Por lo tanto, es habitual que los laboratorios amplíen los tiempos de fijación de las muestras óseas antes de comenzar la descalcificación. Es importante proporcionar un acceso fácil para que el fijador penetre en el hueso, por lo que la piel y el tejido blando deben extraerse de las muestras grandes si es posible. Las muestras óseas deben ser aserradas en cortes finos lo antes posible para mejorar la fijación y proporcionarse un volumen adecuado de fijador. Deben utilizarse sierras de dientes finos de alta calidad para preparar los cortes óseos. Las sierras de dientes gruesos pueden causar daños mecánicos considerables y forzar la introducción de fragmentos óseos en los tejidos blandos presentes en la muestra (consulte la Figura 6).
El formol tamponado es un fijador adecuado para el hueso, pero cuando la conservación de la médula ósea es importante, algunos laboratorios utilizan alternativas como una de las mezclas de formol de zinc, B5, alcohol formol acético (fijador de Davidson) o fijador de Bouin.
Agentes descalcificadores: descripción general
Existen tres tipos principales de agentes descalcificadores:
- Los basados en ácidos minerales fuertes
- Los basados en ácidos orgánicos más débiles
- Los compuestos por agentes quelantes.
Por comodidad, la mayoría de los laboratorios eligen entre los numerosos reactivos patentados disponibles. Los usuarios potenciales de estos productos deben consultar la hoja de datos de seguridad pertinente para determinar el componente activo presente si no está claramente indicado en la información técnica proporcionada.
Agentes descalcificadores: ácidos fuertes
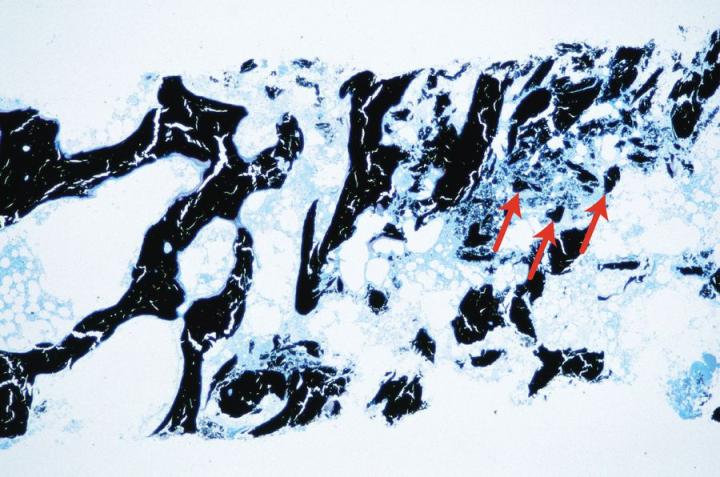
Los ácidos fuertes como el ácido clorhídrico o el ácido nítrico en concentraciones de hasta el 10 % son los más rápidos en acción, pero si se utilizan durante un tiempo excesivo, provocan rápidamente una pérdida de tinción nuclear y pueden macerar los tejidos. Es importante utilizar una prueba de punto final adecuada para minimizar la exposición de las muestras a estos agentes. Por lo general, los descalcificadores patentados de los que se dice que son rápidos en acción se basan en ácidos fuertes, más comúnmente ácido clorhídrico, y deben usarse de forma conservadora prestando atención a las instrucciones proporcionadas si se deben obtener buenos resultados. Por ejemplo, el Decalcifier II® de Surgipath es de acción rápida y contiene ácido clorhídrico. La figura 7 muestra las consecuencias del tratamiento prolongado con un descalcificador de ácidos minerales más allá del criterio de valoración adecuado.
La Tabla 1 enumera varios de los descalcificadores basados en ácidos minerales más comunes. Se deben consultar los libros de texto estándar de histotecnología para obtener una lista más completa.
Tabla 1: Descalcificadores de ácidos minerales
|
Descalcificador |
Fórmula |
Comentario |
|
Ácido nítrico6 |
5 % en agua destilada |
De acción rápida; si se supera el punto final, la tinción se verá afectada. |
|
Líquido de Perenyi6 (1882) |
Ácido nítrico al 10 % 40 ml Ácido crómico al 0,5 %, 30 ml Alcohol absoluto, 30ml |
Un descalcificador tradicional que descalcifica más lentamente que el ácido nítrico acuoso. De acción bastante rápida; si se supera el punto final, la tinción se verá afectada. |
| Ácido clorhídrico3 |
5-10 % en agua destilada |
Debe retirarse toda muestra del formol antes de colocarse en HCl para evitar la formación de éter bis (clorometílico) (un carcinógeno). De acción rápida; si se supera el punto final, la tinción se verá afectada. |
| La solución de Von Ebner6 |
Sol. de cloruro de sodio saturada 50 ml Agua destilada 42 ml Ácido clorhídrico 8 ml |
De acción rápida; si se supera el punto final, la tinción se verá afectada. |
Agentes descalcificadores: ácidos débiles
Los ácidos débiles, como el ácido fórmico, son populares y son ampliamente utilizados para la descalcificación. El ácido fórmico puede usarse como una solución acuosa simple al 10 % o combinado con formol o con un tampón. Aunque es más lento que los agentes ácidos fuertes, actúa con mucho más cuidado y es menos probable que interfiera con la tinción nuclear.1, 7 Un ejemplo de un descalcificador patentado basado en el ácido fórmico es el Decalcifier I® de Surgipath. También contiene formol y se dice que fija y descalcifica y es de acción suave. También se han utilizado otros ácidos como el ácido tricloroacético (TCA). El ácido pícrico, como componente de algunos fijadores, tiene débiles propiedades descalcificadoras.
Tabla 2: Descalcificadores ácidos débiles
|
Descalcificador |
Fórmula |
Comentario |
| Ácido fórmico8 |
10 % en agua destilada |
Un simple descalcificador eficaz. |
| Evans y Krajian8 |
Ácido fórmico 25 ml Citrato sódico 10 g Agua destilada 75 ml |
Un descalcificador eficaz de ácido fórmico tamponado con citrato. |
| Kristensen8 |
Ácido fórmico 18 ml Formiato de sodio 3,5 g Agua destilada 82 ml |
Un eficaz descalcificador de ácido fórmico tamponado con formiato |
| Gooding y Stewart8 |
Ácido fórmico 5-25 ml Formaldehído al 40 % 5 ml Agua destilada 75 ml |
Un descalcificador de ácido fórmico con formol añadido, del que se afirma que fija y descalcifica. |
Agentes descalcificadores: agentes quelantes
Los agentes quelantes como el ácido etilendiaminotetraacético (EDTA) actúan capturando los iones de calcio de la superficie del cristal de apatita, reduciendo lentamente su tamaño. Debido a que el proceso es muy lento pero muy suave (pueden ser necesarias semanas dependiendo del tamaño de la muestra), este reactivo no es adecuado para muestras urgentes, sino más bien para aplicaciones de investigación en las que se requiere una morfología de muy alta calidad o se deben conservar elementos moleculares particulares para técnicas como IHC, FISH o PCR.9 Se utiliza a una concentración de aproximadamente el 14 % como solución neutralizada.1,10 El índice al que se descalcificará la EDTA depende del pH. Generalmente se usa a un pH de 7,0. Actúa más rápidamente a un pH de 10, pero algunos elementos tisulares pueden dañarse cuando se usa un pH alcalino.10
Tabla 3: Agentes quelantes
|
Descalcificador |
Fórmula |
Comentario |
| EDTA neutra1 |
Sal disódica de EDTA 250 g Agua destilada 1750 ml Llevar a un pH de 7,0 añadiendo hidróxido de sodio (se necesitarán unos 25 g). |
Actúa lentamente, pero causa poco daño tisular. Las tinciones convencionales no se ven afectadas en gran medida. |
Factores que influyen en el índice de descalcificación
Concentración.
La concentración del agente activo afectará a la velocidad a la que se elimina el calcio. Las formulaciones publicadas para soluciones descalcificadoras logran un equilibrio entre velocidad y grado de daño tisular. Debe recordarse que la concentración del agente activo se reducirá al combinarse con el calcio, por lo que es aconsejable utilizar un gran volumen de descalcificador y renovarlo varias veces durante el proceso de descalcificación.
Temperatura.
El aumento de la temperatura acelerará el índice de descalcificación, pero también aumentará la tasa de daños en el tejido, por lo que debe aplicarse con gran cuidado.
Agitado.
Un cuidadoso agitado puede aumentar ligeramente el índice.1
Acceso al fluido. Al igual que con la fijación, el descalcificador fresco debe tener un acceso rápido a todas las superficies de la muestra. Esto mejorará la dispersión y penetración en la muestra y facilitará la disolución, ionización y eliminación del calcio.
Otras técnicas para aumentar la eficiencia de la descalcificación
La sonicación utilizada con la EDTA se ha utilizado con éxito para acelerar la descalcificación de muestras de trépano para el análisis molecular posterior. Durante el proceso, la temperatura debe controlarse cuidadosamente.9 El tratamiento por microondas se ha utilizado con descalcificadores de ácido clorhídrico, pero la temperatura elevada puede dañar la morfología y causar artefactos de tinción.10 Las resinas de intercambio iónico se han incorporado en algunos protocolos de descalcificación. Estas se añaden al recipiente que contiene el descalcificador y absorben el calcio ionizado manteniendo la eficacia del ácido. Si los descalcificadores ácidos se utilizan en volúmenes adecuados y se sustituyen regularmente, probablemente no sea necesario el uso de dichas resinas.3 La descalcificación electrolítica en la que el hueso se coloca en un descalcificador ácido y se une a un electrodo a través del cual se aplica corriente es una técnica que no goza de una amplia aceptación debido a la posibilidad que presenta de causar daños por calor a la muestra.3
Determinación del punto final de la descalcificación
Si se deben a obtener resultados de alta calidad, es importante determinar el punto en el que se ha eliminado todo el calcio, porque, a partir de este punto, el daño tisular parece producirse a un ritmo creciente. La descalcificación excesiva, especialmente con los descalcificadores ácidos fuertes, estropea la tinción de elementos basófilos como los núcleos celulares y, en algunas circunstancias, puede causar la maceración de los elementos de tejido más blandos. Por otro lado, las muestras que estén incompletamente descalcificadas pueden ser difíciles o imposibles de seccionarse.
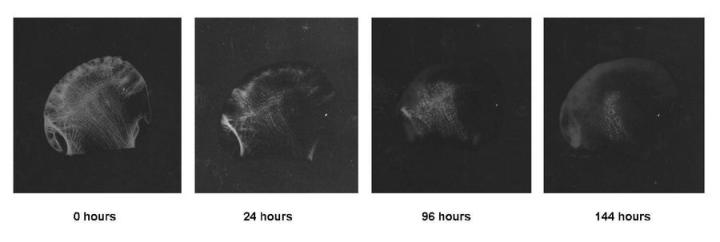
El mejor método, especialmente con muestras grandes, como cabezas femorales, es la realización de radiografías de la muestra. Una radiografía de buena calidad revelará claramente pequeños depósitos residuales de calcio y permitirá un tratamiento adicional si es necesario. Es un método excelente para continuar con el proceso de descalcificación de muestras grandes, como cabezas femorales (consulte la Figura 8). Se puede aplicar una sencilla prueba química cuando se utilizan algunos descalcificadores ácidos (especialmente el ácido fórmico). La solución de oxalato amónico se añade a una muestra del cambio final de descalcificado que se ha neutralizado con hidróxido de amonio.1Si hay calcio presente, se formará un precipitado de oxalato de calcio, lo que indica que la descalcificación es probablemente incompleta y se requiere un tiempo mayor de descalcificación. Por supuesto, esta prueba se realiza mejor tras un cambio relativamente reciente del descalcificador (expuesto al tejido, por ejemplo, solo una hora). Las pruebas físicas requieren cierta manipulación: las muestras se deben doblar, sondear o recortar para “sentir” las áreas calcificadas restantes. Aunque este método puede tener éxito en manos experimentadas, generalmente se considera poco fiable. Pueden producirse daños mecánicos durante el doblamiento o el sondeo, y pueden perderse fácilmente pequeños depósitos de calcio.7 También se ha descrito un método para determinar el punto final pesando cuidadosamente la muestra después de que se haya enjuagado y transferido. Este puede ser un método efectivo para muestras grandes.10
Si cree que se está acercando al punto final de la descalcificación y desea ralentizar el proceso para evitar una descalcificación excesiva y el consiguiente daño tisular, como puede ocurrir cuando su laboratorio quede desocupado durante un fin de semana, las muestras pueden retirarse del descalcificador, enjuagarse y volver a colocarse en formol (importante si se está utilizando ácido clorhídrico). La descalcificación puede reanudarse cuando sea conveniente.10 Una alternativa es refrigerar la muestra a 4 ̊C en su descalcificador para ralentizar el proceso.1
Tratamiento tras la descalcificación y antes del procesamiento
Se han publicado varios métodos para neutralizar el descalcificador ácido residual antes del procesamiento, incluido el lavado a fondo con agua del grifo o la aplicación de soluciones alcalinas. Por lo general, un lavado corto y efectivo con agua del grifo debería ser suficiente, ya que cualquier ácido restante se eliminará durante el procesamiento.1 Es importante eliminar la mayor parte del descalcificador para evitar contaminar los reactivos de procesamiento y el procesador con ácido.
Elección de un programa adecuado para hueso descalcificado u otros tejidos descalcificados
Una vez eliminado el mineral, se puede emplear un programa de procesamiento estándar. Debe tenerse en cuenta que, a pesar de la descalcificación completa, el hueso (en especial el hueso compacto) contendrá áreas densas que requieren un procesamiento pormenorizado. Es mejor utilizar un programa que sea demasiado largo que uno demasiado corto. Su elección dependerá de la naturaleza y el tamaño de la muestra. La aplicación de vacío durante la infiltración en parafina debería mejorar la calidad de los bloques terminados.
Descalcificación de superficies
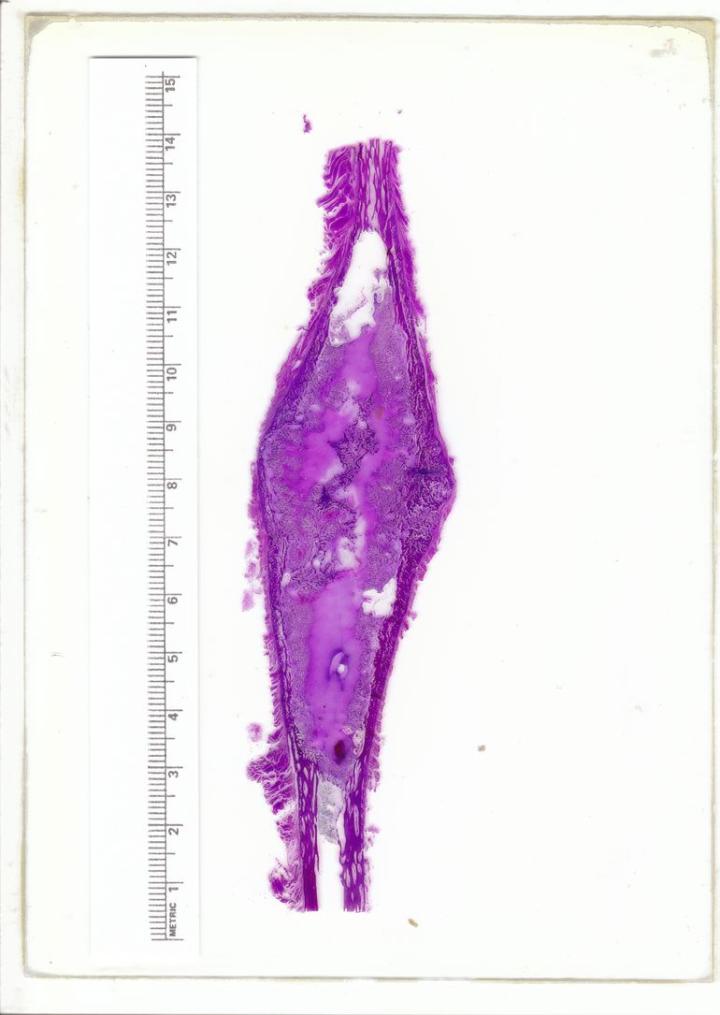
Se trata de un método de manejar pequeños depósitos inesperados de calcio que se pueden encontrar en bloques de parafina (consulte la Figura 10). Normalmente, el calcio se descubre después de cortar el bloque en el microtomo para exponer la muestra. En esta fase, es importante intentar evitar alterar ampliamente la superficie del bloque. Una vez expuesto el tejido, el bloque puede retirarse del microtomo y colocarse boca abajo en un descalcificador ácido durante 15-60 minutos. Este tratamiento de la superficie permitirá que el descalcificador penetre una pequeña distancia en el bloque y disuelva el calcio. Después, el bloque se puede aclarar profusamente con agua para eliminar el ácido residual, tanto refrigerado como cortado. Será necesaria la realineación cuidadosa del bloque, ya que el descalcificador penetrará una distancia muy pequeña en el bloque, lo que permite que solo se tomen un par de secciones.1, 11

Conclusión
La descalcificación es un proceso sencillo, pero para que sea exitoso, se necesita:
- Una cuidadosa evaluación preliminar de la muestra
- Una fijación exhaustiva
- Una preparación de cortes de grosor razonable para la fijación y el procesamiento
- La elección de un descalcificador adecuado con el volumen adecuado, que sea cambiado regularmente
- Una determinación cuidadosa del criterio de valoración
- Un procesamiento exhaustivo utilizando un programa adecuado.
About the presenter

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
Referencias
- Page KM. Bone. In Bancroft JD and Stevens A eds. Theory and Practice of Histological Techniques. New York: Churchill Livingstone, 1996.
- Moore RJ. Bone. In Woods AE and Ellis RC eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;7.2-10.
- Carson FL. Histotechnology. 2nd ed. Chicago: ASCP Press, 2007.
- Vardaxis NJ. Pathology for the health sciences. Melbourne: Macmillan Australia Pty Ltd, 1997.
- Young B, Heath JW. Wheater's Functional Histology. 4th ed. Edinburgh: Churchill Livingstone, 2000.
- Clayden EC. Practical section cutting and staining. Edinburgh: Churchill Livingstone, 1971.
- Skinner RA, Hickmon SG, Lumpkin CK, Aronson J, Nicholas RW. Decalcified Bone: Twenty Years of Successful Specimen Management. The Journal of Histotechnology 1997;20;267-277.
- Wallington EA. Histological Methods for Bone. London: Butterworths, 1972.
- Reineke T, Jenni B, Abdou MT et al. Ultrasonic Decalcification Offers New Perspectives for Rapid FISH , DNA, and RT_PCR Ananlysis in Bone Marrow Trephines Am J Surgical Pathology 2006;30.
- Callis G, Sterchi D. Decalcification of Bone: Literature Review and Practical Study of Various Decalcifying Agents, Methods, and Their Effects on Bone Histology. The Journal of Histotechnology 1998;21;49-58.
- Rolls GO. Difficult Blocks and Reprocessing. Leica Microsystems, 2011.
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.