
LAS VENTAJAS DEL PROCESAMIENTO MÚLTIPLE DE TEJIDOS

El procesamiento de tejidos es uno de los elementos más críticos para obtener resultados de calidad y a tiempo en el proceso histológico. El procesamiento de tejidos en el laboratorio se prepara con muestra infiltrando el tejido con parafina para cortarlo en láminas finas y prepararlo para la tinción. Los fijadores, los protocolos de procesamiento, el tipo de tejido y el tamaño son factores críticos para obtener unos resultados óptimos en el procesamiento de tejidos.1 Según Frieda Carson, el mayor problema al procesar tejidos es procesar tanto muestras de biopsia como muestras de tejidos grandes [de rutina] en la misma serie de procesamiento.2 Los tejidos pueden procesarse en exceso, es decir, pueden parecer cocidos, quebradizos, crujientes, secos o pulverulentos, o no procesarse lo suficiente y no poder ser cortados. Las biopsias y los tejidos de muestras más grandes deben procesarse por separado utilizando un protocolo específico para cada muestra.3
Método
Este estudio, realizado por el equipo de contenidos y pruebas de Leica Biosystems, tuvo lugar en un pequeño laboratorio independiente. El laboratorio estaba interesado en una revisión completa de sus procesos actuales y en recomendaciones para mejorar la calidad y los plazos de entrega. Como resultado de las observaciones iniciales, el equipo se centró en las prácticas de procesamiento de tejidos del laboratorio.
RESULTADOS
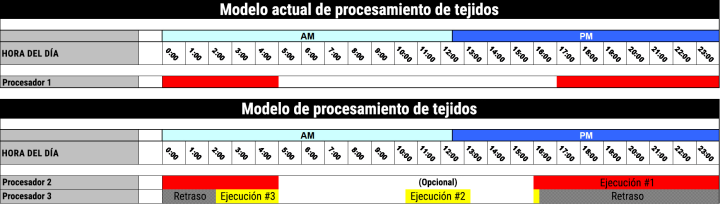
Discusión
El equipo de contenido y pruebas de Leica Biosystems examinó el programa actual de procesamiento de tejidos del laboratorio. El laboratorio utiliza un único procesador de tejidos con una sola retorta para el procesamiento de lotes durante la noche para todos los tipos de muestras, incluidas las biopsias y el tejido de rutina. Los tamaños tan variables de los tejidos de biopsia frente a los de rutina, e incluso los tejidos grasos, requieren considerables cambios de tiempo en los reactivos de procesamiento. La combinación de tipos de tejido en un lote de una noche puede dar lugar a un procesamiento excesivo de las biopsias y a un procesamiento incompleto de los tejidos de rutina de mayor tamaño. El tejido que no se procesa lo suficiente al principio se retira de la carga de trabajo diaria y se vuelve a procesar en la siguiente tanda de procesamiento nocturno, lo que retrasa el tiempo de respuesta en esos casos en más de 24 horas.
Como resultado de esta evaluación, la recomendación es separar los programas de procesamiento para adaptarse a los distintos tipos y tamaños de tejido:
- Ejecución nº 1: durante la noche y durante 12 horas para las muestras de rutina
- Ejecución nº 2 (opcional): durante el día y durante 2 horas para las biopsias
- Ejecución nº 3: una ejecución retrasada para las biopsias recibidas durante la tarde.
Para mantener el flujo de trabajo actual y el solapamiento de los ciclos (es decir, la biopsia diferida y el ciclo de 12 horas), este modelo de procesamiento sólo podría llevarse a cabo pasando de 1 procesador de tejidos a 2 procesadores de tejidos o de un procesador de una sola retorta a un procesador de doble retorta.
Conclusión
En última instancia, para obtener muestras de tejido procesadas con la calidad deseada, pueden ser necesarios ciclos de procesamiento separados en función del tamaño del tejido. La adición de un pequeño ciclo de biopsia durante el día, un ciclo diferido para las biopsias y un ciclo nocturno ampliado para el tejido de rutina puede aumentar el rendimiento y reducir el tiempo de procesamiento de las biopsias.
Las proyecciones y los resultados obtenidos son específicos de la institución en la que se obtuvieron y pueden no reflejar los resultados alcanzables en otras instituciones.
About the presenter

Ashley Troutman has been involved in Laboratory Medicine for more than 20 years in clinical, research and administrative capacities. He has worked in facilities of all sizes, from small community hospitals and private labs to large academic medical centers and corporate reference labs. He has extensive experience in laboratory science and management, specifically in anatomic pathology and immunohistochemistry. He has managed routine histology operations and has been part of the team to aid researchers in designing experiments using histologic techniques. These roles have allowed Ashley to lead work process implementation teams that saw success in scientific innovation as well as improving laboratory efficiency through areas of waste/cost reduction, process improvement and safety.
Referencias
- Survarna, S. Kim, Layton, Christopher and Bancroft, John D.; Bancroft’s Theory and Practice of Histological Techniques; 7th edition; 2013
- Carson, Frieda L.; Histologic Fixation and Sample Processing;
- Bancroft’s Theory and Practice of Histological Techniques: Expert Consult
Related Content
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.


