
Tinciones especiales: ¿cuál, cómo y por qué? Parte III: Microorganismos: bacterias y hongos

Definir microorganismos
Los microorganismos son organismos vivos, lo que incluye bacterias, hongos, protozoos y virus. Son tan pequeños que requieren la ayuda de un microscopio para poder ser observados, a veces incluso se necesita un microscopio electrónico. Las bacterias, hongos y protozoos pueden identificarse y clasificarse con procedimientos histoquímicos, y los virus generalmente se identifican con procedimientos inmunohistoquímicos.
Introducción a los microorganismos: bacterias
Los microorganismos consisten en microorganismos unicelulares de un tamaño de unos pocos micromilímetros. Estos tres son muy comunes para los seres humanos: mycobacterium tuberculosis, mycobacterium leprae y helicobacter pylori.
MYCOBACTERIUM TUBERCULOSIS
causa tuberculosis, es inmóvil y tiene forma de bastoncillo, y se caracteriza e identifica por una propiedad conocida como “acidorresistente”, lo que significa que una vez absorbido, el colorante utilizado para teñir los bacilos no debe eliminarse cuando se incube en un enjuague ácido. El método preferido de identificación es una tinción de AFB, denominada también tinción de bacterias acidorresistentes (BAAR en español)
El ácido micólico es el mecanismo responsable de la propiedad acidorresistente. Esta sustancia cerosa es producida por las paredes de las bacterias. Este ácido se une con las sustancias de las paredes celulares de las bacterias, haciéndolas resistentes a la decoloración del tratamiento con un alcohol ácido. Las opciones más comunes de las tinciones de AFB son carbol fucsina de Kinyouin o carbol fucsina de Ziehl-Neelsen. Las soluciones, los procedimientos y los resultados son similares para ambas.
Carbol fucsina de Kinyouin
El proceso

Los resultados
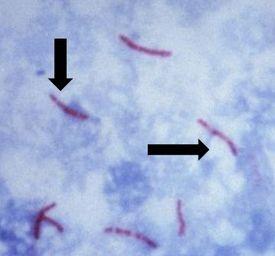
El protocolo
Los tiempos de incubación pueden variar según el fabricante
|
1. |
Ponga las preparaciones en agua |
|
|
2. |
Carbol fucsina (temperatura ambiente) |
Entre 30 y 60 min |
|
3. |
La aplicación de calor a 60 ºC puede acortar los tiempos de incubación |
|
|
4. |
Enjuague bien con agua corriente |
5 min |
|
5. |
Alcohol ácido HCL al 1 % (alcohol al 70 %) |
10 seg |
|
6. |
Enjuague bien con agua corriente |
2 min |
|
7. |
Azul de metileno al color deseado |
Entre 30 y 40 seg |
|
8. |
Enjuagar brevemente con agua corriente |
15 seg |
|
9. |
Se deshidrata rápidamente con alcoholes |
|
|
10. |
Aclarar y montar |
Resolución de problemas de la tinción de AFB:
Es muy importante enjuagar bien después de aplicar carbol fucsina para eliminar el exceso de solución. Asegúrese de que el nivel de agua cubre completamente toda la preparación. Los residuos de tinte pueden extenderse a través del tejido y ensuciar los resultados. La decoloración se producirá rápidamente. Incube en HCL/EtOH al 70 % hasta que la preparación en el portaobjetos de vidrio esté limpia y el tejido tenga un aspecto ligeramente rosado. Después de la decoloración, aclare en agua, lavándolo muy bien y asegurándose de no dejar ningún ácido/EtOH en la preparación. Con el azul de metileno, menos es más. Si realiza una tinción excesiva en esta contratinción, los bacilos BAAR (ácido alcohol resistentes, AFB en inglés) pueden enmascararse. Hay una línea fina entre demasiado azul de metileno y demasiado poco. Si hay demasiado, puede que no se lave fácilmente y acabe enmascarando los bacilos. Si hay muy poca cantidad, puede que se elimine todo durante el lavado y por tanto no deje contraste. El ensayo y el error y la experiencia son la mejor respuesta.
Como se indicó anteriormente, el azul de metileno se puede eliminar rápidamente con alcoholes, así que asegúrese de comenzar con el 100 % para la deshidratación y pase las preparaciones rápidamente a través de 2 cambios solo para eliminar el agua de estos.
MYCOBACTERIUM LEPRAE
produce lepra y tiene propiedades acidorresistentes similares a M. Tuberculosis, pero es mucho menos eficaz. La tinción preferida para la demostración es la de Fite-Faraco.
Fite-Faraco
El proceso


Los resultados

El protocolo
Los tiempos de incubación pueden variar según el fabricante.
|
1. |
Secar las preparaciones en el horno |
|
|
2. |
Incubar en una mezcla 50/50 de xileno/aceite de cacahuete |
15 min |
|
3. |
Repetir con una segunda mezcla 50/50 |
15 min |
|
4. |
Secar con papel secante, lavar con agua, repetir para eliminar el aceite |
5 min |
|
5. |
Carbol fucsina de Fite (temperatura ambiente) |
20 min |
|
6. |
Enjuague bien con agua corriente |
|
|
7. |
HCL al 1 %/Alcohol al 70 % |
Entre 1 y 5 seg |
|
8. |
Enjuagar con agua corriente |
|
|
9. |
Azul de metileno |
Entre 10 y 20 seg |
|
10. |
Enjuagar rápidamente con agua corriente |
|
|
11. |
Secar con papel secante, no colocar en alcoholes, aclarar y montar |
Resolución de problemas de la tinción Fite-Faraco:
Si las preparaciones se colocan accidentalmente en xileno y alcoholes siguiendo un protocolo normal de desparafinado, realice dos preparaciones nuevas y vuelva a empezar. Para obtener los mejores resultados, siga las mismas directrices para carbol fucsina de Kinyouin.
HELICOBACTER PYLORI
tiene forma de espiral y está asociada a inflamación gástrica, úlceras pépticas y carcinoma gástrico. Tienen propiedades argirófilas y no pueden absorber ni reducir la plata. Las tinciones preferidas para la demostración son la tinción de Warthin Starry con plata o una de las muchas modificaciones, tinción Giemsa y procedimientos de inmunohistoquímica (los más sensibles).
Plata Warthin Starry
El proceso

Los resultados

El protocolo
Los tiempos de incubación pueden variar según las directrices del fabricante
Nota: La tinción con plata Warthin Starry se utiliza para demostrar muchos microorganismos variados, no solo H. Pylori. Por este motivo, puede encontrar protocolos que difieran del protocolo específico para H. Pylori a continuación.
|
1. |
Ponga las preparaciones en agua |
|
|
2. |
Enjuagar con agua desionizada |
|
|
3. |
Nitrato de plata del 0,5 % al 1 %, precalentado a 65 °C |
3–5 min |
|
4. |
Desarrollador/solución reductora |
1–5 min |
• Colocar las preparaciones en un frasco Coplin que contenga solución
• Añadir el frasco Coplin al baño de agua precalentado a 65 °C
• Incubar hasta que la sección de tejido adquiera un color marrón/dorado

|
5. |
Enjuagar con agua tibia |
2–3 min |
|
6. |
Deshidratar en alcoholes absolutos |
|
|
7. |
Aclarar y montar |
Resolución de problemas de la tinción de Warthin Starry con plata para H. Pylori
Resolución de problemas de la tinción de Warthin Starry con plata para H. Pylori:
La tinción de Warthin Starry puede ser difícil de dominar. Asegúrese de seguir todas las instrucciones del fabricante para la mezcla de soluciones. Use instrumental de vidrio limpio y agua desionizada cuando se solicite. Es importante precalentar un baño de agua para la plata y el revelador/reductor. La plata debe estar a 65 °C cuando se carguen las preparaciones. A medida que el revelador/reductor se calienta, el tejido comenzará a desarrollar un color marrón/dorado cuando el proceso haya casi terminado. La agitación en la solución de revelador/reductor creará una preparación con una tinción más uniforme.
Nota: El calentamiento por microondas puede sustituirse por el calentamiento por baño de agua. Los tiempos deben ajustarse.
Giemsa
Giemsa es una tinción policromática compuesta de tintes con diferentes tonalidades.
El proceso

Los resultados

El protocolo
Los tiempos de incubación pueden variar según las directrices del fabricante
|
1. |
Deshidratar con metanol al 95 % |
|
|
2. |
Solución de trabajo de Jenner |
10 min |
|
3. |
Solución de trabajo de Giemsa |
45 min |
|
4. |
Agua de ácido acético glacial al 1 % |
10 seg |
|
5. |
Enjuague rápido con agua corriente |
|
|
6. |
Secar bien con papel secante, aclarar y montar |
Resolución de problemas de Jenner-Giemsa para H. Pylori:
Jenner y Giemsa son dos soluciones muy inestables y deben prepararse de nuevo para cada uso. Filtre ambas antes de usarlas. El paso del ácido acético glacial es fundamental. Una tinción insuficiente provocará una diferenciación deficiente en las células. Una tinción excesiva eliminará la mayor parte de la tinción. Seque en vez de deshidratar mediante alcoholes, ya que, si no, todo el azul de h. Pylori se eliminará.
Una comparación de tres procedimientos para la demostración de H. Pylori.



Introducción a los microorganismos: hongos
Los hongos consisten en organismos monocelulares y multicelulares con distintos núcleos y paredes celulares. Tres hongos comunes que causan enfermedades en humanos son cryptococcus neoformans, histoplasma capsulatum y pneumocystis carinii.
CRYPTOCOCCUS NEOFORMANS
vive en el medio ambiente en todo el mundo y puede causar meningitis en los seres humanos. Las infecciones suelen producirse en personas inmunodeprimidas. Las cápsulas quedan claramente demostradas mediante la tinción con mucicarmina, así como por un procedimiento con plata metenamina (véase el proceso a continuación).
Mucicarmina
El proceso

Los resultados

El protocolo
Los tiempos de incubación pueden variar según las directrices del fabricante.
|
1. |
Pasar las preparaciones por agua |
|
|
2. |
Hematoxilina de Weigert de trabajo |
5–10 min |
|
3. |
Enjuagar con agua corriente |
|
|
4. |
Solución de mucicarmina de trabajo |
20–30 min |
|
5. |
Enjuagar con agua corriente |
|
|
6. |
Amarillo de metanil |
1–3 min |
|
7. |
Enjuagar brevemente con agua corriente |
|
|
8. |
Deshidratar, aclarar y montar |
Resolución de problemas de la tinción con mucicarmina:
Siga las instrucciones del fabricante para hacer que la mucicarmina funcione. Recuerde diluirla de acuerdo con las instrucciones y utilizar el agua adecuada para la dilución (destilada frente a agua corriente). Use solución de Wiegert fresca. Si su solución de Wiegert no es púrpura, sino más bien parduzca, significa que se ha descompuesto y sus núcleos no se teñirán correctamente. La solución de trabajo de Wiegert puede durar un día completo, pero normalmente no toda la noche.
HISTOPLASMA CAPSULATUM
provoca histoplasmosis. La infección se produce por la respiración de estas esporas, lo que provoca síntomas similares a los de la gripe. Si no se trata, puede diseminarse por todo el cuerpo y causar la muerte. Es más frecuente en pacientes inmunodeprimidos. Se puede mostrar mediante la tinción con plata de metenamina de Gomori.
PNEUMOCYSTIS CARINII
se clasificó previamente como protozoo, pero ahora se considera un hongo en base al ácido nucleico y el análisis bioquímico. Puede dar lugar a una neumonía mortal en pacientes inmunodeprimidos. Se puede mostrar mediante la tinción con plata de metenamina de Gomori.
Plata de metenamina de Gomori
La plata de metenamina de Gomori depende de unas células que tienen una propiedad argentafín. Puede reducir los iones de plata invisibles a plata metálica visible sin una ayuda externa y es opuesto a lo argirófilo, como se observa en H. Pylori.
El proceso
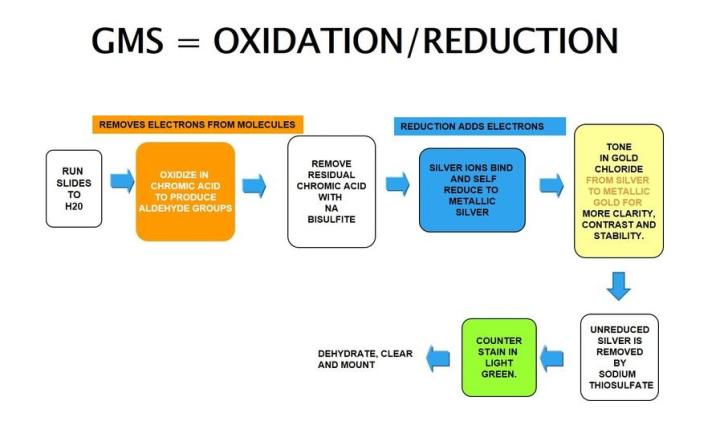
Los resultados



El protocolo
|
1. |
Ponga las preparaciones en agua |
|
|
2. |
Oxidar en ácido crómico |
10 min |
|
3. |
Enjuague bien con agua corriente |
3 min |
|
4. |
Bisulfito sódico |
1 min |
|
5. |
Enjuagar con agua corriente |
|
|
6. |
Incubar en solución de plata de metenamina a 60 ºC. |
10 – 20 min |
|
7. |
El tiempo de incubación viene determinado por la velocidad de impregnación |
|
|
8. |
Enjuagar con agua desionizada |
|
|
9. |
Cloruro de oro |
1 – 2 min |
|
10. |
Enjuagar con agua corriente |
|
|
11. |
Tiosulfato de sodio |
1 min |
|
12. |
Enjuagar con agua corriente |
|
|
13. |
Contratinción en verde claro |
30 - 40 seg |
|
14. |
Enjuagar rápidamente con agua corriente |
|
|
15. |
Deshidratar, aclarar y montar |
Solución de problemas de la tinción Giemsa o de GMS:
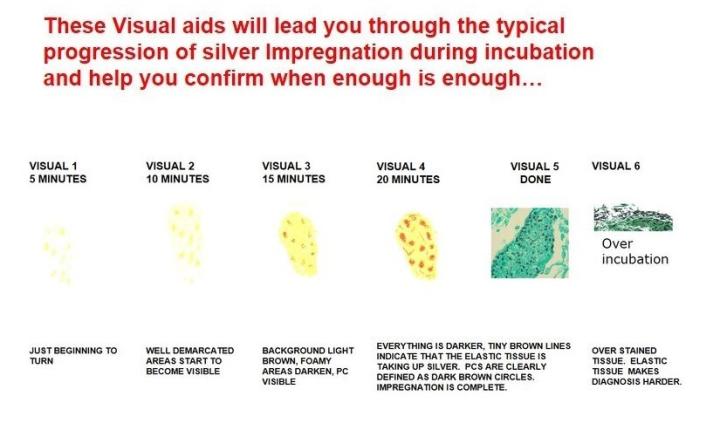
El ácido crómico debe cambiarse con frecuencia para promover la oxidación completa y depende del número de preparaciones procesadas. Mantener el recipiente cerrado cuando no se esté utilizando. Los tiempos de impregnación (si se realizan manualmente) requieren cierto ensayo y error, dependiendo del método de calentamiento utilizado (baño de agua u horno microondas). No teñir en exceso con verde claro, ya que esto puede enmascarar el organismo que desea mostrar.
GMS para Pneumocystis
About the presenter

Carolyn Doan received her ASCP registration in 1969 after completing classes at Georgia State University and St Joseph school of Histotechnology in Atlanta, Georgia. For 40 years she shared her passion for histology in research (at Yerkes Primate Research Center), in the clinical world (managing the Pathology Department at Florida Hospital in Orlando and serving on the board of the Florida State Licensure Task Force and as president of the Florida State Society for Histotechnology), and in industry (as a Sales executive, Marketing Manager and North American staining sales specialist). Since her retirement in 2013, she founded Creative Histology Consulting.
Referencias
- Geoffrey Rolls. “101 Steps to Better Histology – A Practical Guide to Good Histology Practice”. Líderes/artículos de patología
- Shaikh, Dr. Imran, “Special Stains in Histopathology.” Kem Hospital, 2012
- Ellis, Roy. IMVS Division of Pathology, The Queen Elizabeth Hospital, Woodville Road, South Australia
- Wikipedia encyclopedia – Pneumocystis Carinii
- Kerr, DA: Improved Warthin Starry Method for Tissue Sections; Am J Clin Pathol; 1938, 8:63-67
- Dacie y Lewis, Practical Hematology, 12th edition, 2017
- ncbi.nlm.nih.gov/pubmed/8173783 - The Identity of Pneumocystis Carinii
- Sheehan/Hrapchak. “Theory and Practice of Histotechnology.” Microorganisms. 2nd edition, 13: 233-251
- Derm101.com Ackerman, A. Bernard (2000)
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.