
Información fundamental sobre la tinción Hematoxilina-Eosina (H&E), Parte 4: Resolución de problemas con las tinciones con H&E

Aunque la tinción con H&E es relativamente sencilla de realizar, existen diversos artefactos que pueden interferir con una buena tinción. Los artefactos pueden atribuirse a diversas causas.
El corte a menudo desempeña un papel esencial para lograr tinciones de buena calidad. Las secciones gruesas y finas, las rugosidades, los tejidos con "explosiones" y las moscas flotantes de los baños de agua son artefactos de corte que pueden afectar negativamente a la forma en que el tejido capta la tinción.
Los cortes gruesos y finos suelen ser el resultado de una técnica deficiente en la estación de corte debido a una rotación irregular del microtomo. Muchos laboratorios utilizan ahora el corte automatizado en microtomos no solo para reducir las lesiones ergonómicas, sino también para obtener preparaciones uniformemente cortadas de forma constante.

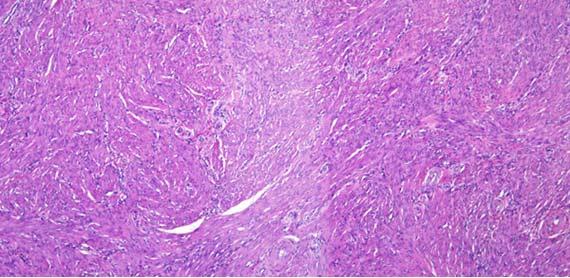

Las secciones con rugosidades y explosiones suelen estar relacionadas con el procesamiento de tejidos. Las rugosidades son resultado de un tejido excesivamente deshidratado/sobreprocesado y los cortes con "explosiones" de tejidos insuficientemente procesados/mal infiltrados. Puede observarse fácilmente otro indicador de tejidos excesivamente procesados cuando se observan los glóbulos rojos (eritrocitos, RBC) en los vasos.

El agua se utiliza a menudo como diferenciador de la eosina, ya que puede eliminar suavemente el exceso de eosina de la preparación. Los alcoholes deshidratantes y el primer alcohol al 100 % pueden contener suficiente agua para provocar el aclarado de la eosina y una mayor diferenciación de la misma. Demasiados pasos con "agua o alcohol diluido" darán lugar a tonos más claros de eosina y a una tinción insuficiente de las estructuras citoplasmáticas.
Durante la tinción, el agua puede entrar en los alcoholes (después de la eosina) debido a la contaminación entre los pasos. Cuando los reactivos no se cambian con regularidad, el contenido de agua continúa aumentando y se transfiere a los xilenos siguientes antes colocar el cubreobjetos. Con el tiempo, este exceso de agua en el xileno puede provocar la filtración de la eosina del tejido. Se ve en la preparación como una neblina rosa. Este artefacto puede producirse incluso si el xileno no está visiblemente contaminado con agua.

La contaminación no es la única forma de introducir agua en los xilenos. La humedad ambiental puede provocar cambios en la rapidez con la que el xileno se contamina con agua.
Según la ubicación geográfica, la calidad del agua puede variar bastante. La fluoración, el pH u otros minerales presentes pueden afectar no solo a la forma en que los colorantes son captados por el tejido, sino también a la vida de los colorantes. Debido a que la hematoxilina, por ejemplo, es ligeramente ácida, un agua corriente de pH básico puede elevar el pH de la hematoxilina, haciéndola menos eficaz. Si la calidad del agua del grifo es deficiente o variable, el uso de agua desionizada (DI) es una excelente opción. Asegúrese de que la presión del agua desionizada es suficiente para la estación de tinción de la plataforma.
Los tejidos congelados pueden ser muestras muy difíciles de teñir. El tiempo es muy importante y a los equipos se les pide constantemente que acorten los tiempos de tinción para permitir al patólogo dar una respuesta rápida al personal quirúrgico. Dicho esto, puede ser difícil encontrar el equilibrio entre una tinción de calidad y la velocidad.
Uno de los artefactos más grandes que he experimentado es una tinción irregular no relacionada con el corte de tejido congelado. El motivo principal es acelerar la fijación y enjuagar la preparación antes de la tinción. Recuerde que el medio utilizado para apoyar los tejidos congelados durante el corte es soluble en agua y DEBE retirarse de la muestra, no como la eliminación de la parafina de las muestras rutinarias antes de la tinción. El medio puede evitar la infiltración uniforme del colorante, igual que la cera de parafina. Y, a diferencia de la parafina, probablemente no verá ningún residuo de material en la preparación al final de la tinción, porque los pasos durante la tinción eliminarán el material por el camino.

El personal del laboratorio no suele recoger las muestras, por lo que es esencial educar al personal encargado de ello. La recogida de muestras con gasas, toallitas de papel, aplicadores con punta de algodón u otros dispositivos intermedios puede secar las muestras mediante la simple transferencia de agua del tejido al dispositivo. Este artefacto se observa con mayor frecuencia con las biopsias, especialmente cuando se recogen varias muestras del mismo paciente utilizando el mismo dispositivo de recogida. En estos casos, cuando el enjuague del dispositivo de recogida con formol pueda dañar al paciente, se deben utilizar materiales no porosos para retirar el tejido del dispositivo. También puede utilizarse solución salina para enjuagar el tejido del dispositivo en otro recipiente, ya que no provocará la eliminación del agua de la muestra recogida.

Las muestras deben recogerse y sumergirse inmediatamente en el fijador para garantizar una fijación adecuada. El formol es el fijador más comúnmente utilizado en el laboratorio y proporciona buenos detalles a nivel nuclear. Sin embargo, el formol debe tratarse como cualquier otro reactivo, específicamente con respecto a las fechas de conservación y caducidad. Dejar formol bajo la luz solar directa puede alterar el pH de la solución, causando un entorno ácido para los tejidos. La acidez de los fijadores tiende a tener dos impactos principales en los tejidos:
- Quemado de los bordes exteriores de los tejidos
- Secado excesivo de los tejidos
El quemado se produce cuando el borde exterior de la muestra se ha alterado adoptando un aspecto "chamuscado". Este cambio también impide la infiltración adecuada del reactivo en la muestra, ya que las proteínas a lo largo de la parte externa de la muestra crean una barrera que impide que el reactivo penetre y el agua salga.
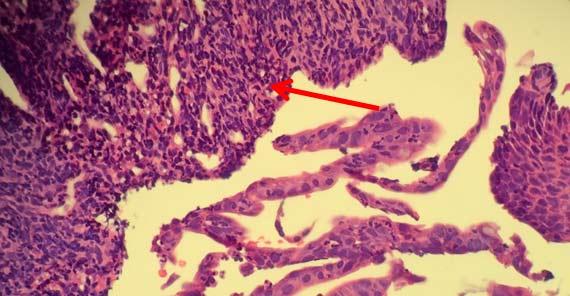
Dependiendo del nivel de acidez, los tejidos pueden simplemente volverse demasiado secos. Cuando surjan dudas sobre la viabilidad del formol, es mejor comenzar con un reactivo nuevo para reducir el riesgo de daño tisular.
A medida que los procesadores de tejidos continúan evolucionando, también deben hacerlo nuestras técnicas de procesamiento. El tiempo de los protocolos de procesamiento se está optimizando cada vez más para satisfacer las necesidades de los pacientes mediante la creación de procedimientos eficaces. Por este motivo, reunir todas las muestras en el mismo protocolo ya no es razonable. Las muestras pequeñas procesadas con un protocolo nocturno se deshidratarán en exceso, lo que dificultará el corte. El remojo puede ayudar, pero a menudo el tejido mostrará un agrietamiento excesivo. Las muestras grandes colocadas con un protocolo más adecuado para biopsias estarán insuficientemente deshidratadas y es probable que no se puedan cortar hasta que no se haya completado el procesamiento adecuado.

El burbujeo nuclear se produce cuando las proteínas del núcleo se coagulan. Este artefacto es a menudo el resultado de muestras mal fijadas que han sido sometidas a un alto nivel de calor. Un fijador de pH alto también puede hacer que aparezcan burbujas. El entorno hostil hace que las proteínas se coagulen alrededor de pequeñas gotas de líquido, lo que les da la apariencia de burbujas de jabón. Lamentablemente, no hay forma de eliminar este artefacto una vez que se ha producido.

Después del corte, las preparaciones húmedas suelen colocarse en un horno para que se sequen. Las altas temperaturas (p. ej., 70 °C) pueden hacer que el agua bajo la sección se evapore rápidamente a través del tejido. La evaporación puede hacer que las proteínas se coagulen, provocando el artefacto de burbujas de jabón. La mejor forma de evitar las burbujas en este caso es bajar la temperatura del horno o dejar que las preparaciones se sequen un poco al aire antes de colocarlas en el horno.
Por desgracia, las moscas flotantes son demasiado comunes. La clave para determinar la fuente de estas es fijarse en qué zona del portaobjetos aparecen en relación con el tejido. Si se encuentran en el mismo plano de enfoque que la muestra de tejido, lo más probable es que haya sido un contaminante en el bloque (ya sea de la fase de tallado o de la de inclusión).
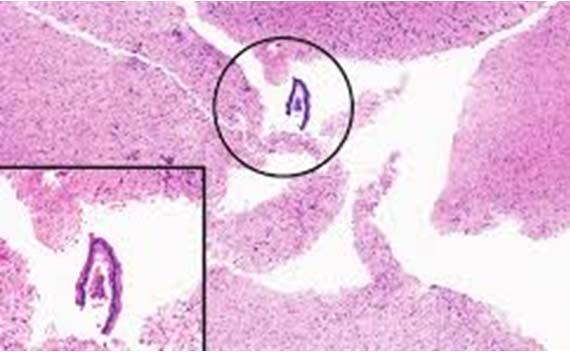
La contaminación externa (p. ej., baños de agua o dentro de los reactivos de tinción) normalmente mostrará moscas volantes por encima del tejido o fuera del plano del tejido. En cualquier caso, mantener limpias las áreas de tallado e inclusión, utilizar un baño de agua limpia y cambiar o filtrar con frecuencia los reactivos son los mejores medios para evitar las moscas flotantes.

Las bacterias y los hongos pueden crecer en los recipientes de tinción y de reactivos si estas zonas no se limpian con regularidad. Siga las instrucciones del fabricante para el mantenimiento del instrumento. Recuerde que, aunque la lejía es adecuada para la mayoría de las cosas, puede causar problemas en el instrumento.


Tenga en cuenta que el cuerpo puede producir, y produce, materiales que pueden aparecer en las tinciones de H&E como pigmento. La melanina, la hemosiderina (glóbulos rojos viejos) y los residuos inflamatorios pueden causar distracción. Incluso los fijadores pueden crear pigmentos extracelulares, como los de Zenker, que pueden ser preocupantes si el patólogo no es consciente de que la muestra se fijó en algo que no era formol. Aunque la solución de Zenker (dicromato de potasio/cloruro de mercurio) está ampliamente prohibido debido a su toxicidad, hay algunos laboratorios que pueden seguir fabricándolo. Anotar cualquier circunstancia de fijación inusual que pueda alterar la tinción.

Históricamente, los laboratorios de histología han utilizado todo tipo de técnicas para adherir tejidos a los portaobjetos. En el pasado, cuando los portaobjetos cargados se consideraban demasiado costosos para el seccionado rutinario, los laboratorios dependían de la albúmina u otras proteínas para ayudar a los tejidos a adherirse a los portaobjetos. Los reactivos comerciales estaban (y todavía están) disponibles para utilizarse como aditivos para el baño de agua. El reto, sin embargo, es la uniformidad. Cada técnico llenará su baño de agua de forma diferente y añadirá diferentes cantidades de adhesivo al baño. Aunque una persona pueda ser generosa con la cantidad de adhesivo, otra puede quedarse corta, lo que dificulta el control de la tinción de fondo.
Los adhesivos tienen sus propias limitaciones (p. ej., en la tinción de fondo con H&E) y pueden incluso interferir con las tinciones inmunohistoquímicas.
Actualmente, las preparaciones cargadas son fáciles de conseguir y funcionan bien con tinciones de laboratorio, lo que reduce la probabilidad de anomalías del fondo u otras anomalías asociadas con los adhesivos. Debido a que todas las preparaciones se tratan de forma sistemática, la variabilidad entre estas es limitada.
Disponer de preparaciones cargadas y de adhesivos significa que su uso conjunto debería hacer que el tejido se adhiera aún mejor, ¿verdad? ¡Incorrecto! La naturaleza de ambos métodos es atraer iones del tejido. Cuando se usan juntos, las propiedades de ambos se anulan entre sí, básicamente cambiando la preparación con carga positiva en un portaobjetos de vidrio simple.
Los sustitutos del xileno están ahora ampliamente disponibles y pueden proporcionar una capa adicional de seguridad al laboratorio. Tenga en cuenta que vienen con su propio conjunto de limitaciones, como una baja tolerancia al agua. También puede ser necesario utilizar un medio de montaje compatible según las recomendaciones del fabricante, ya que no todos son compatibles con los medios de montaje típicos basados en xileno.
Aunque los sustitutos del xileno son generalmente más seguros, deben tratarse con el mismo nivel de precaución que el xileno. Las leyes de eliminación de residuos varían según la región, pero los sustitutos del xileno SIEMPRE deben desecharse de la misma manera que el xileno y no verterse por el desagüe. Estos reactivos siguen siendo hidrocarburos que no son respetuosos con el medio ambiente. También suelen ser bastante aromáticos, por lo que los laboratorios que utilizan sustitutos tienden a necesitar una ventilación algo mejor para combatir el olor.
Hay otros alcoholes en el mercado que pueden funcionar bien para la tinción, como el etanol. El metanol, el alcohol isopropílico (IPA) y el Flex son los más comunes y pueden ser más rentables para los laboratorios que el uso de etanol. Los fabricantes de alcohol Flex combinan etanol, metanol e IPA en diferentes mezclas, así que asegúrese de obtener los porcentajes de contenido (si es posible). Si tiene alguna duda sobre el uso de un reactivo en particular en una estación de tinción, consulte siempre al fabricante del instrumento para conocer la compatibilidad. Al final, asegúrese de que la tinción se valide internamente.
Una de las formas más sencillas de mantener el buen aspecto de las preparaciones con H&E es simplemente asegurarse de cambiar frecuentemente los reactivos. La mayoría de los fabricantes proporcionan cierta información sobre el número de preparaciones que sus reactivos pueden tolerar antes de que deban cambiarse. Aunque estos datos son una guía, haga lo que sea más lógico para su laboratorio. Si el cambio de reactivos a diario es mejor, entonces cámbielos a diario.
Actualmente, la mayoría de los laboratorios utilizan algún tipo de plataforma de tinción. Esto no solo libera a los técnicos para que se dediquen a otras cosas, sino que también aporta una mayor uniformidad en la tinción. Sin embargo, como todos los demás instrumentos del laboratorio, el mantenimiento y el control de calidad son imprescindibles para el éxito de la tinción. Limpie y mantenga la estación de tinción según las especificaciones del fabricante.
Si el laboratorio tiene un gran volumen de trabajo, puede ser apropiado reducir el tiempo entre las tareas de mantenimiento. De cualquier manera, pida SIEMPRE a un ingeniero capacitado que realice los trabajos mecánicos en el instrumento. La mayoría de las empresas ofrecen planes de servicio que permiten a los usuarios llamar para solicitar soporte técnico y normalmente también programan un mantenimiento preventivo. ¡Vaya con cuidado con las empresas que intenten prestar servicio sin mostrar sus credenciales para el instrumento! El mal servicio de un proveedor externo puede ser tan perjudicial como no recibir ningún servicio en absoluto.
Aunque esto parezca bastante lógico, es sorprendente la gran cantidad de equipos que dedican poco tiempo a formar al personal sobre sus instrumentos. La realización de comprobaciones periódicas de competencias y ofrecer oportunidades para que los miembros del equipo actualicen sus conocimientos a través de seminarios web u otra formación externa es una excelente forma de asegurarse de que todos entienden los fundamentos de la tinción.
Obviamente, conseguir que todos estén de acuerdo sobre cuál es la mejor tinción puede ser un reto. Puede ser más fácil programar cualquier tinción que se esté utilizando para aceptar varios protocolos con tiempos ligeramente diferentes, de modo que los patólogos tengan varias opciones. También creo un sistema de código sencillo para que sepa cuáles son los tiempos de tinción, pero los patólogos tendrán que responder basándose solo en lo que ven.
Al ajustar la coloración, lo mejor es no complicarse. Los siguientes ajustes suelen funcionar bien:
- Hematoxilina +/- 30 segundos
- Eosina Y +/- 15 segundos
Por lo general, es útil hacer solo un ajuste a la vez. Estos tiempos son suficientes para hacer cambios sutiles. Sin embargo, puede ser más agresivo si es necesario. Si la hematoxilina es demasiado ligera, no dude en aumentar el tiempo en un minuto o más. De todos modos, para pequeños ajustes, los tiempos anteriores tienden a funcionar bien.
RECUERDE: A veces, simplemente ajustar la hematoxilina o la eosina puede ser suficiente para hacer que la otra sea más brillante o más clara, dependiendo de lo que esté buscando.
About the presenter

Cindy Sampias is a board certified Cyto- and Histo-technologist. With more than 25 years of experience, she is a guest speaker at histology and cytology meetings around the country. She is a technical author for Media Lab, publishing a variety of technical courses and sharing best practices in histology.
Related Content
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.



