
Congelación de muestras biológicas Miles Cunningham
Los investigadores neurocientíficos normalmente necesitan ver cortes de todo el cerebro para determinar la ubicación en el cerebro de los detalles que están viendo bajo el microscopio. Es necesario endurecer el cerebro para poder hacer cortes finos, a menos que se utilice un microtomo de cuchilla vibrante, que es mucho más lento. La inclusión en parafina, tal como se usa comúnmente para muestras médicas, funciona solo para muestras pequeñas o finas, pues la parafina no penetrará hasta el centro de todo el cerebro de un roedor. Por lo tanto, los investigadores neurocientíficos suelen utilizar la congelación para endurecer el tejido cerebral para el corte.
Tres formas sólidas de agua
La congelación daña las membranas celulares y reduce la legibilidad histológica de las muestras biológicas. Presentamos un análisis del por qué, las consecuencias y cómo minimizar o evitar el daño cuando se utiliza la congelación como medio para endurecer el tejido biológico con el fin de cortar secciones finas para histología.
El agua pura puede existir en estado sólido en tres formas. Hay dos formas cristalinas, cristal hexagonal y cristal cúbico. El agua también puede congelarse tan rápidamente que no tenga tiempo para formar cristales y permanece amorfa (forma vítrea). La formación de cristal es responsable de la expansión del agua a medida que se congela (la expansión en congelación es una propiedad exclusiva del agua), por lo que el hielo vítreo no se expande con la solidificación. Esto lo convierte en la única forma deseable de congelación para muestras biológicas.
Tasa de congelación crítica
La expansión del contenido de agua mediante congelación estira y penetra en las membranas celulares. La congelación lenta promueve la formación de cristales de hielo y, por tanto, la expansión. Los materiales biológicos son conductores térmicos deficientes. Por lo tanto, es probable que existan gradientes térmicos a medida que la muestra se congela, y se formarán algunos cristales de hielo en el interior de cualquier trozo de tejido a más de 10 mm de la fuente fría. Si se colocan sobre una superficie fría para su congelación, las muestras se congelarán lentamente y, por tanto, es probable que formen cristales, especialmente en las partes más distales de la superficie de congelación. Cuando se corte, el tejido congelado lentamente con una formación de cristal grande presentará el conocido efecto de “queso suizo”, es decir, múltiples orificios con contenido celular perdido, en grados variables, dependiendo del grado y tamaño de la formación de cristal.
Tenga en cuenta que la tasa de congelación, y no la temperatura final, es crítica al principio. La congelación rápida depende del porcentaje de superficie total en contacto con la fuente de frío, el volumen de agua, la temperatura inicial del agua (muestra) y cuán fría es la fuente. Idealmente, la fuente de frío está a una temperatura extremadamente baja y dispuesta de tal forma que esté en contacto con todas las superficies.
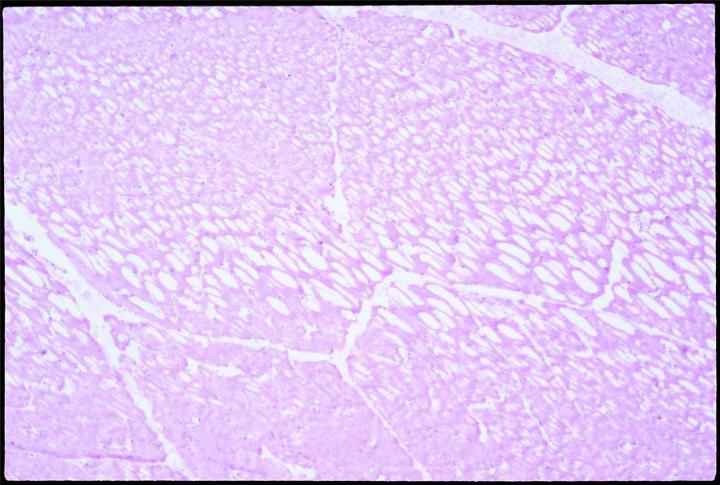
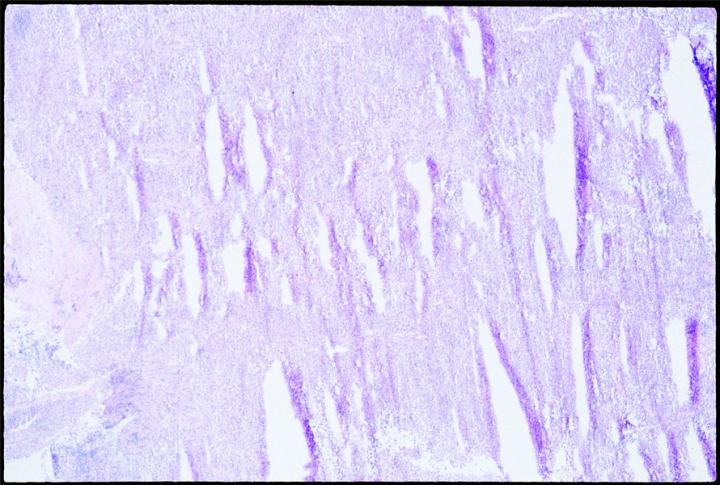

Realización de los cortes lo antes posible
Sin embargo, aunque una muestra se congele rápidamente como vítrea, puede que no permanezca así. El hielo vítreo es un estado inestable. A más de -121 ̊C, el hielo amorfo comienza a reestructurarse gradualmente como hielo cúbico y expandirse. A más de -80 ̊C, el hielo cúbico comienza a reestructurarse como hielo hexagonal y se expande de nuevo. Afortunadamente, este es un proceso de conversión lento, dependiendo de los gradientes de temperatura y la pureza del agua.
En la mayoría de las aplicaciones comunes, el tejido debe calentarse por encima de la temperatura de congelación instantánea para cortarlo (de -9 a -19 ̊C para el cerebro, pero depende del tipo de tejido). De lo contrario, es demasiado frío para cortarlo y se rompe cuando es doblado por el bisel de la cuchilla. El síntoma visible de un corte a temperaturas demasiado frías es el “efecto persiana” o las marcas de rotura paralelas a la hoja de la cuchilla. El corte debe comenzar tan pronto como el tejido esté lo suficientemente caliente como para ser cortado. El tejido nunca debe dejarse durante la noche ni durante largos períodos en un criostato, incluso si no hay ciclo de descongelación. Se iniciará la conversión del hielo vítreo a los grandes cristales hexagonales. Los cristales expandirán el hielo y dañarán las células.
Nitrógeno líquido
Para una congelación más rápida, la inmersión en un líquido crea el mayor contacto superficial. Una segunda alternativa aceptable es colocar el tejido en un pedestal metálico preenfriado y rodearlo rápidamente con hielo seco en polvo para maximizar el contacto con la superficie.
El nitrógeno líquido es uno de los líquidos más fríos disponibles de forma rutinaria. No se mezcla con el tejido. Estas propiedades parecen convertirlo en un medio de congelación ideal. Sin embargo, el nitrógeno líquido tiene una constante de calor específico extremadamente baja. Esto hace que hierva de forma local y copiosa en el punto de contacto incluso con una pequeña porción de tejido más caliente. Una consecuencia es que una barrera de vapor, una capa de gas nitrógeno, puede acumularse junto al tejido y aislar y ralentizar la penetración del frío en el mismo, ralentizando así la velocidad de congelación en un patrón impredecible. Como resultado, a menudo ocurre que la capa externa de tejido se congela rápidamente y se forma hielo vítreo, pero luego se forma la barrera de vapor, el frío penetra más lentamente y la parte interna se congela más lentamente. La formación de cristal expande el tejido dentro de la cubierta congelada y todo el bloque se agrieta. Un bloque agrietado indica que al menos el tejido más interno se ha congelado de forma cristalizada. Tenga en cuenta que esto es un problema con los bloques grandes de tejido (por ejemplo, una rata entera o incluso el cerebro de un ratón), pero el nitrógeno líquido funciona muy bien para congelar biopsias o muestras más pequeñas, y se utiliza con éxito en laboratorios de histología clínica.
Otras soluciones
Para bloques más grandes, se utilizan otros líquidos de forma más fiable, especialmente el isopentano refrigerado hasta -80 ̊C. Este no forma barreras de vapor y, si el tejido es poco más que un centímetro cúbico, se congelará en su totalidad como hielo vítreo. La inmersión total en el líquido es necesaria para un máximo contacto superficial e inofensivo con el tejido. El movimiento a través del líquido es útil.
Otra solución es permear o perfundir el tejido con glicerina, polietilenglicol (anticongelante), glicerol o soluciones de sacarosa. Estos alteran la formación de cristales y reducen la temperatura de congelación. La sacarosa al 30 % en tampón fosfato se utiliza habitualmente, pero solo con tejido bien fijado, después de la fijación, ya que la osmolaridad se reduciría al tejido no fijado.
About the presenter
Referencias
- Jongebloed, W.L., Stokroos, D., Kalicharan, D., and Van der Want, J.J.L. Is Cryopreservation Superior Over Tannic Acid/Arginine/Osmium Tetroxide non-Coating Preparation in Field Emission Scanning Electron Microscopy. Scanning Microscopy 13: 93-109, 1999.
- Reid N. and Beesley J. Sectioning and Cryosectioning for Electron Microscopy. Practical Methods in Electron Microscopy, Vol 13, Elsevier, Amsterdam
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.
