
Fijación y fijadores (2): factores que influyen en la fijación química, el formaldehído y el glutaraldehído

Esta segunda parte de la serie de Fijación y Fijadores trata los factores que influyen en la velocidad y la efectividad de la fijación tisular, así como en la observación de dos fijadores comunes: formaldehído (histología) y glutaraldehído (estudios de microscopía electrónica ultraestructural).
Factores que influyen en la fijación química
Existen diversos factores que influirán en la tasa y la eficacia de la fijación de tejido.
Temperatura: El aumento de la temperatura de fijación aumentará la velocidad de difusión del fijador en el tejido y acelerará la velocidad de reacción química entre el fijador y los elementos tisulares. También puede aumentar potencialmente la tasa de degeneración tisular en áreas no fijadas de la muestra. Para la microscopía óptica, la fijación inicial suele llevarse a cabo a temperatura ambiente y puede ir seguida de una fijación adicional a temperaturas de hasta 45 °C durante el procesamiento del tejido. Se trata de un compromiso que parece estar ampliamente aceptado para producir una conservación morfológica de buena calidad. La fijación con microondas puede implicar el uso de temperaturas más altas, de hasta 65 °C, pero durante períodos relativamente cortos. Consulte la Parte 5 para más información.
Tiempo: El tiempo óptimo de fijación varía según cuál sea el fijador. Para que se produzca la fijación, el fijador tiene que penetrar, mediante difusión, en el centro de la muestra y, a continuación, se debe dejar el tiempo suficiente para que se produzcan las reacciones de fijación. Tanto el tiempo de difusión como el tiempo de reacción dependen del reactivo particular utilizado, y el tiempo óptimo variará de un fijador a otro. En los laboratorios de diagnóstico ajetreados hay una presión considerable para reducir el tiempo de respuesta y esto puede dar lugar al procesamiento de tejidos que no han sido completamente fijados. Esto puede provocar cortes de mala calidad que muestren distorsión tisular y tinción de mala calidad porque el tejido mal fijado no se procesa bien. Recuerde que si el tejido fijado de forma incompleta se extrae del formol y se coloca en etanol durante el procesamiento, el etanol continuará fijando el tejido y la imagen morfológica en el centro de la muestra será la de la fijación con etanol.
Tasa de penetración: La tasa de penetración de un agente fijador depende de sus características de difusión y varía de un agente a otro. Según Medawar, se puede expresar como d = K√t, donde d es la profundidad de penetración, K es el coeficiente de difusión (específico para cada fijador) y t es el tiempo. 1 En términos prácticos, esto significa que el coeficiente de difusión (K) es la distancia en milímetros que el fijador ha difundido en el tejido en una hora. Para formol al 10 %, K = 0,78. Esto significa que no debería esperarse que su fijador de formalina penetre más de 1 mm en una hora y que tardará aproximadamente 25 horas en penetrar en el centro de una muestra de 10 mm de grosor, es decir, 5 mm ( = 5² horas).

Dimensiones de la muestra: Las aproximaciones anteriores enfatizan la importancia de las dimensiones de la muestra al fijar el tejido. Una muestra no debe tener más de 4 mm de grosor. Idealmente, un corte de 3 mm de grosor debería proporcionar una fijación y un procesamiento excelentes. Es útil recordar que la cavidad de la muestra en un casete de procesamiento estándar tiene una profundidad de 5 mm.
Relación de volumen: Es importante tener un volumen de fijador de reserva en relación con el volumen total de tejido, ya que con los fijadores aditivos la concentración efectiva de reactivo se reduce a medida que avanza la fijación y en un volumen total pequeño esto podría tener un efecto sobre la calidad de la fijación. Una relación fijador/tejido de 20:1 se considera la relación aceptable más baja, pero yo recomiendo una relación objetivo de 50:1.
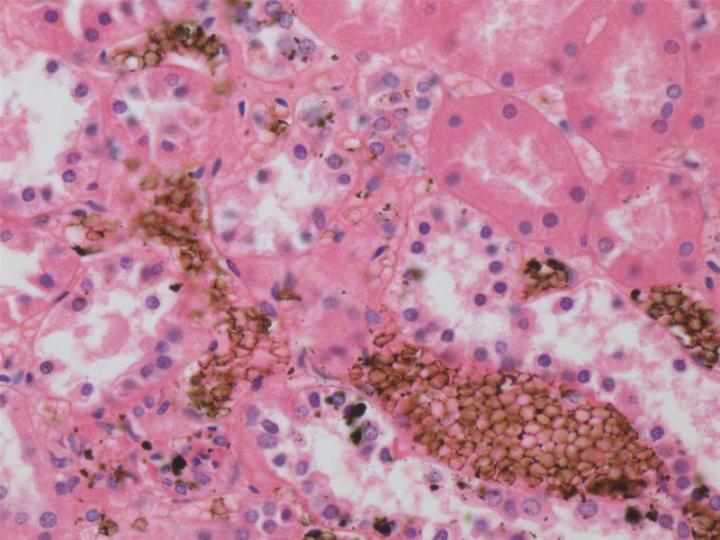
pH y tampones: A nivel del microscopio óptico, el pH de un fijador no parece afectar en gran medida la calidad de la conservación, ya que varias formulaciones tienen un pH bastante bajo, como las que contienen ácidos acéticos o pícricos. Sin embargo, el pH puede ser importante por otras razones, como en el caso de las soluciones de formaldehído, donde la descomposición del formaldehído en ácido fórmico produce una solución ácida que, a su vez, reacciona con la hemoglobina y produce un pigmento artefacto (hematina de formaldehído ácido). Por este motivo, la solución de formaldehído más popular que se utiliza hoy en día está tamponada con un pH de entre 6,8 y 7,2. Para la microscopía electrónica, el pH es más importante y debe coincidir con el pH fisiológico. 2
Osmolalidad: Los efectos osmóticos ejercidos por el fijador son más importantes de nuevo a nivel ultraestructural que a nivel del microscopio óptico porque son las membranas fosfolípidas las que se dañan fácilmente con soluciones excesivamente hipotónicas o hipertónicas, pero la osmolalidad tiene cierta relevancia en la histopatología rutinaria. Por lo general, lo más importante es la osmolalidad del vehículo (tampón) y en algunas formulaciones se ajusta para que se parezca a la del líquido tisular (p. ej., formalina en solución salina isotónica). Antes de que se produzca la fijación, las células pueden resultar dañadas por fluidos no isotónicos como el agua y, si las muestras no se pueden fijar inmediatamente, pueden mantenerse húmedas con una gasa empapada en solución salina isotónica durante un breve periodo de tiempo. No es buena idea mantener el tejido sumergido en solución salina durante períodos prolongados.
Agentes de fijación
Hay una serie de reactivos que se pueden utilizar para fijar tejidos. En el presente documento le hablamos del formaldehído, con diferencia el agente más popular utilizado para histopatología, y el glutaraldehído, ampliamente utilizado para estudios ultraestructurales que requieren microscopía electrónica. En la Parte 3 se analizan otros reactivos.
Formaldehído: El formaldehído (CH2O) es el único aldehído gaseoso y se disuelve en agua hasta una saturación de entre el 37 % y el 40 % p/v. Esta solución generalmente se denomina “formol” o “solución concentrada de formaldehído”. Para la fijación, una parte de formol se diluye normalmente en nueve partes de agua o tampón. Esto produce una solución de formol al 10 % que contiene aproximadamente un 4 % de formaldehído p/v, una concentración óptima para la fijación. El formaldehído en soluciones concentradas existe como metilenglicol monohidrato y como hidratos poliméricos de bajo peso molecular. El monohidrato predomina en su forma diluida. El paraformaldehído, una forma altamente polimerizada de formaldehído, puede depositarse como un precipitado blanco en soluciones concentradas de formaldehído. Para evitar que esto suceda, se suelen añadir pequeñas cantidades de metanol (hasta un 15 %) a las soluciones patentadas. El paraformaldehído puede adquirirse como polvo seco y utilizarse para preparar soluciones de formaldehído altamente puras como las necesarias para la microscopía electrónica. 2, 3
La formalina no tamponada se oxidará lentamente hasta formar ácido fórmico, lo que da como resultado una caída del pH. En estas condiciones, el ácido fórmico reaccionará con la hemoglobina formando hematina ácida de formaldehído, un pigmento artefacto granular marrón-negro que se deposita en los tejidos ricos en sangre. Este pigmento es una molestia, ya que puede confundirse con microorganismos u otros pigmentos patológicos. 4 Aunque el pigmento puede eliminarse de las secciones con ácido pícrico acuoso saturado antes de la tinción, es preferible evitar su formación desde el principio. Por este motivo y debido a que el formaldehído reacciona de forma más efectiva a un pH aproximadamente neutro, las soluciones de formol al 10 % normalmente se tamponan a un pH de entre 6,8 y 7,2.
El formaldehído reacciona con las cadenas laterales de las proteínas para formar grupos hidroximetil reactivos. Este puede penetrar en proteínas nucleares y ácidos nucleicos estabilizando la capa de ácido nucleico-proteína y modificando los nucleótidos mediante la reacción con grupos amino libres. El formaldehído puede reaccionar con algunos grupos en lípidos insaturados, especialmente si hay iones de calcio presentes, pero tiende a no ser reactivo con los carbohidratos. 5 El formaldehído puede reaccionar con los grupos en complejos reactivos de formación de lisina, arginina, cisteína, tirosina, treonina, serina y glutamina, que pueden combinarse entre sí formando puentes de metileno (enlaces cruzados) o con grupos de hidrógeno. 5 Está ampliamente aceptado el hecho de que lavar los tejidos después de la fijación con formol puede revertir algunas de estas reacciones, pero los enlaces cruzados importantes permanecen. 6 Es la capacidad del formaldehído para preservar los péptidos de las proteínas celulares lo que lo ha hecho tan útil como fijador para uso general.
Existen riesgos bien conocidos asociados al uso de formaldehído como fijador al entrar este en contacto con la piel o los ojos o a través de las vías respiratorias. Es irritante, corrosivo y puede causar sensibilización alérgica. A partir de 1981, el formaldehído se clasificó como “razonablemente previsto como carcinógeno humano” y en 2011 la valoración se ha actualizado a “conocido como carcinógeno humano”.7, 8 Estudios han demostrado que el formaldehído causa cáncer nasofaríngeo, cáncer nasosinusal y leucemia mieloide. Por estos motivos, en la mayoría de los países existen directrices estrictas para limitar la exposición de los trabajadores al formaldehído en el lugar de trabajo. Por ejemplo, en los EE. UU., el límite de exposición permisible (PEL) de la OSHA es de 0,75 ppm (8 horas en TWA) y un límite de exposición a corto plazo (STEL) de 2 ppm (15 minutos de exposición), y estas recomendaciones están respaldadas por un programa de monitorización regular. En un laboratorio bien equipado con equipos modernos de extracción de humos, estos niveles objetivo no deberían superarse.9, 10
A pesar de los riesgos del uso de formaldehído, la mayoría de los expertos en morfología han conseguido ampliar sus conocimientos de los tejidos normales y enfermos gracias a la observación de muestras fijadas en formol. Como ahora somos conscientes de los peligros tóxicos de este reactivo, muchos laboratorios han buscado y siguen buscando una alternativa más segura. Sin embargo, las alternativas al formol son juzgadas generalmente por su capacidad para producir una imagen morfológica similar, si no mejor, a la producida por el formol y permitir una gama completa de métodos de tinción, incluidos los métodos moleculares, todo ello siendo igual de económicas. La mayoría de los laboratorios siguen utilizando formol porque no encuentran un sustituto completamente satisfactorio, por lo que es importante que el personal sea consciente de los peligros implicados. En la Parte 3 analizamos algunas alternativas al formaldehído.
Glutaraldehído: El glutaraldehído o dialdehído glutárico (CHO(CH2)3CHO) se considera un aldehído bifuncional, que posee grupos aldehídos en cualquiera de los extremos de la molécula que tienen el potencial de reaccionar con los mismos grupos químicos que el formaldehído. Estos formarán compuestos de adición y puentes de metileno, pero también una única molécula de glutaraldehído puede formar enlaces cruzados directos si la disposición estérica de los péptidos adyacentes lo permite. Los grupos amino de la lisina son especialmente importantes en este sentido. El tejido fijado en glutaraldehído contará con más enlaces cruzados que el tejido fijado en formol y también poseerá algunos grupos de aldehído sin reaccionar que, a menos que se bloqueen químicamente, pueden causar tinción de fondo en métodos como el PAS. Este mayor número de enlaces cruzados afecta negativamente a la tinción inmunohistoquímica, pero proporciona una excelente conservación ultraestructural que explica su amplio uso como fijador primario para la microscopía electrónica. Las reacciones de enlaces cruzados del glutaraldehído son en gran medida irreversibles. El glutaraldehído penetra muy lentamente y se recomienda que el tejido tenga menos de 1 mm de grosor en al menos una dimensión. 5, 11
El glutaraldehído se descompone lentamente para formar ácido glutárico y también se polimeriza para formar compuestos cíclicos y oligoméricos. El glutaraldehído, por lo tanto, se obtiene mejor en ampollas selladas en una forma conveniente “estabilizada para microscopía electrónica” y se puede añadir a un tampón adecuado a un pH de 7,2 – 7,4 (normalmente cacodilato, fosfato o maleato) para producir una concentración de glutaraldehído al 3 % para su uso. Para la microscopía electrónica, la fijación primaria de glutaraldehído suele ir seguida de una fijación secundaria en tetróxido de osmio. El glutaraldehído no se utiliza normalmente para histopatología de rutina. 11

About the presenter

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
Referencias
- Medawar PB. The rate of penetration of fixatives. J Royal Micros Soc 1941;61;46-57.
- Carson FL. Histotechnology. 2nd ed. Chicago: ASCP Press, 1997.
- Leong AS-Y. Fixation and fixatives. In Woods AE and Ellis RC eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;4.1-1 - 4.1-26.
- Rolls GO, Farmer NJ, Hall JB. Artefacts in histological and cytological preparations. In Woods A and Ellis R eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;5.3-1 - 5.3-29.
- Eltoum I, Fredenburgh J, Myers RB, Grizzle WE. Introduction to the theory and practice of fixation of tissues. J Histotechnol 2001;24;173 -190.
- Eltoum I, Fredenburgh J, Grizzle WE. . Advanced concepts in fixation: 1. Effects of fixation on immunohistochemistry, reversibility of fixation and recovery of proteins, nucleic acids, and other molecules from fixed and processed tissues. 2. Developmental methods of fixation. J Histotechnol 2001;24;201-210.
- NTP. Report on carcinogens, Twelfth Edition. National Toxicology Program, USA Department of Health and Human Services, 2011; http://ntp.niehs.nih.gov/ntp/roc/twelfth/roc12.pdf November 7, 2011
- NTP. Addendum to the 12th Report on Carcinogens. USA Department of Health and Human Services, National Toxicology Program, 2011; http://ntp.niehs.nih.gov/ntp/roc/twelfth/Addendum.pdf November 7, 2011
- OSHA. Occupational Safety and Health Standards. Standard Number: 1910.1048 : Formaldehyde. United States Department of Labor, Occupational Safety and Health Administration, 2011; http://www.osha.gov/pls/oshaweb/owadisp.show_document?p_id=10075&p_table=STANDARDS November 7, 2011
- Leica, Microsystems. Material Safety Data Sheet: 10% Millonig’s Buffered Formalin. 2007; http://www.leica-microsystems.com/index.php?id=1504&tx_leicaproducts_pi1[showUid]=3299&tx_leicaproducts_pi1[tab]=downloads&cHash=49baf1391ce5bcd25cd31e224782b369 27/10/2011
- Bozzola JJ, Russell LD. Electron microscopy: principles and techniques for biologists. Boston: Jones and Bartlett, 1992
Related Content
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.



