
Una introducción a la tinción rutinaria y especial


La tinción de rutina con H&E y las tinciones especiales desempeñan un papel fundamental en el diagnóstico o la investigación basados en tejidos. Al colorear secciones de tejido transparentes, estas tinciones permiten a patólogos e investigadores altamente cualificados ver, bajo un microscopio, la morfología del tejido (estructura) o buscar la presencia o prevalencia de tipos de células particulares, estructuras o incluso microorganismos como bacterias.
En el laboratorio de histopatología, el término “tinción rutinaria” se refiere a la tinción con hematoxilina y eosina (H&E) que se utiliza “de forma rutinaria” con todas las muestras de tejido para revelar las estructuras y condiciones tisulares subyacentes. El término “tinciones especiales” se ha utilizado durante mucho tiempo para hacer referencia a un gran número de técnicas de tinción alternativas que se utilizan cuando la técnica con H&E no proporciona toda la información que el patólogo o investigador necesita.
Preparación del tejido para la tinción
Antes de poder teñir y ver el tejido, debe prepararse de forma que una sección muy fina, de una sola célula de grosor, pueda cortarse y colocarse en un portaobjetos de microscopio. Esto implica fijar el tejido (para que no se descomponga) y luego endurecerlo y darle soporte para que pueda cortarse en secciones muy finas (normalmente de 2–7 μm). Para esto, se utilizan dos técnicas principales, denominadas secciones congeladas y secciones incluidas en parafina.
Las secciones congeladas se utilizan cuando se necesitan respuestas rápidas, normalmente durante una cirugía, cuando el cirujano necesita conocer el margen de escisión al extirpar un tumor. Su producción es rápida, pero normalmente no ofrecen la misma calidad de sección que la técnica de parafina. El proceso para la preparación de secciones congeladas es el siguiente:
- El tejido se congela rápidamente para ser conservado y endurecido.
- El tejido congelado se secciona en un criostato (un microtomo de corte en una cámara de congelación) y se coloca en una preparación de microscopio para su tinción.
- La sección se fija inmediatamente antes de que comience a descomponerse y, luego, se tiñe.
Cuando se preparan cortes de parafina, la muestra se conserva primero con un fijador y, a continuación, se da soporte a la estructura tisular infiltrando la muestra en parafina. El proceso requiere más tiempo que la creación de secciones congeladas, pero proporciona una tinción de mejor calidad en la mayoría de los casos y las muestras resultantes (denominadas bloques) se pueden almacenar casi indefinidamente. El proceso de corte en parafina es el siguiente:
- La fijación conserva el tejido (normalmente con una solución basada en formaldehído).
- El tallado aísla el área particular del tejido que se va a cortar.
- El procesamiento de tejidos utiliza una secuencia de reactivos para sustituir un entorno acuoso (basado en agua) por uno hidrófobo que permite infiltrar los elementos tisulares en parafina.
- La inclusión permite la orientación de la muestra y la fija en un bloque de parafina para el corte y almacenamiento de la sección.
- El corte se realiza en un microtomo que corta secciones muy finas que se hacen flotar en un baño de agua y luego se recogen y colocan en una preparación de microscopio.
- A continuación, las preparaciones se secan en un horno o en una placa calefactora para eliminar la humedad y ayudar a que el tejido se adhiera al portaobjetos.
- El tejido del portaobjetos ahora ya está listo para la tinción.
- El primer paso de la tinción es la eliminación de la parafina, para lo cual se utiliza un disolvente para eliminar la parafina de la preparación antes de la tinción. Esto siempre se hace como parte del proceso de tinción. Cuando se completa una tinción, la sección se cubre con un cubreobjetos que hace que la preparación sea permanente.

Por qué la tinción con H&E es rutinaria
La tinción con hematoxilina y eosina (H&E) se utiliza de forma rutinaria en laboratorios de histopatología, ya que proporciona al patólogo/investigador una vista muy detallada del tejido. Esto se consigue mediante la tinción clara de estructuras celulares, incluido el citoplasma, el núcleo y los orgánulos y los componentes extracelulares. Esta información es a menudo suficiente para permitir un diagnóstico de enfermedad basado en la organización (o desorganización) de las células y también muestra cualquier anomalía o indicador particular en las células reales (como los cambios nucleares que normalmente se observan en el cáncer). Incluso cuando se utilizan métodos de tinción avanzados, la tinción H&E sigue formando una parte crítica del panorama diagnóstico, ya que muestra la morfología tisular subyacente que permite al patólogo/investigador interpretar correctamente la tinción avanzada.
En un laboratorio de histología clínica, todas las muestras se tiñen inicialmente con H&E y las tinciones especiales o avanzadas solo se solicitan si se necesita información adicional para proporcionar un análisis más detallado, por ejemplo, para diferenciar entre dos tipos de cáncer morfológicamente similares.
Debido al volumen de tinción de H&E necesario, la mayoría de los laboratorios clínicos utilizan sistemas totalmente automatizados y la tinción manual es hoy en día poco frecuente.
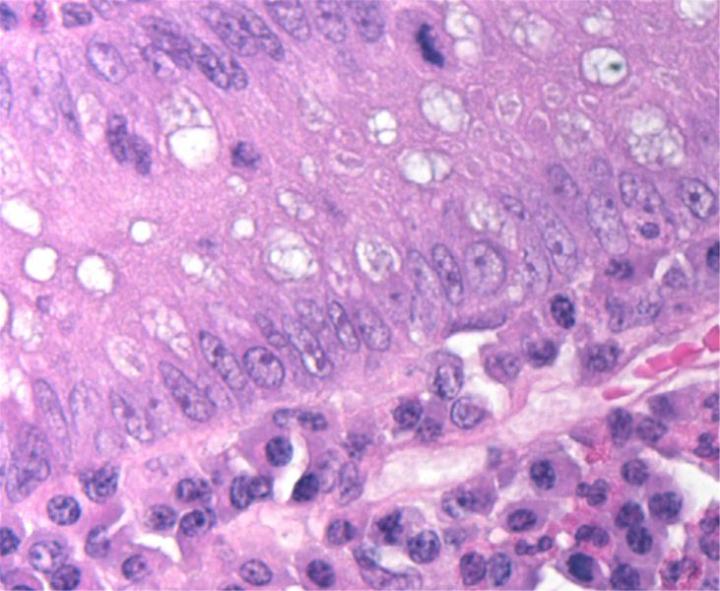

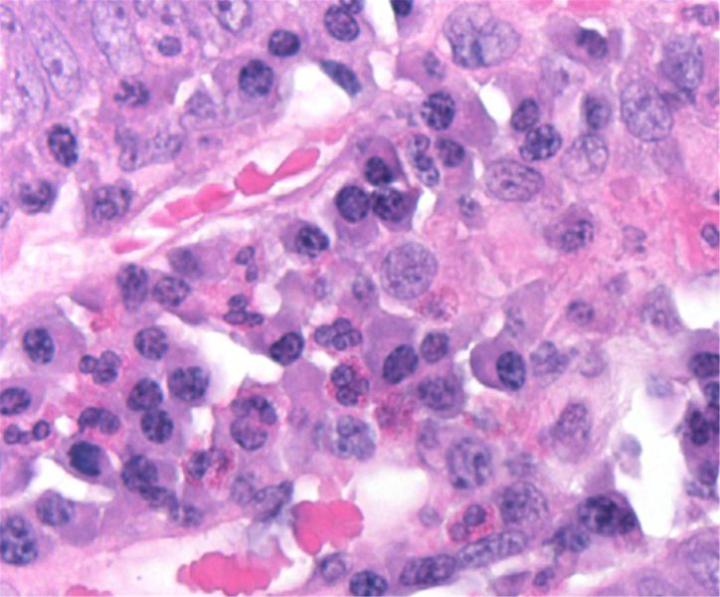

Química de la H&E
La tinción H&E utiliza dos colorantes: hematoxilina y eosina. Esta combinación se utiliza debido a que cada uno de estos colorantes tiñe diferentes elementos tisulares.
La hematoxilina reacciona como un tinte básico con un color azul púrpura. Tiñe la estructura ácida o basófila, incluido el núcleo celular (que contiene ADN y nucleoproteína) y los orgánulos que contienen ARN como los ribosomas y el retículo endoplasmático rugoso.
La eosina es un colorante ácido que normalmente da un color rojizo o rosa. Tiñe estructuras básicas, o acidófilas, que incluyen el citoplasma, las paredes celulares y las fibras extracelulares.
Fuentes de los colorantes
La hematoxilina se extrae de un árbol llamado palo de Campeche y se purifica. Luego se oxida y se combina con un mordiente (normalmente aluminio) para permitir que se una a las estructuras celulares. De las muchas preparaciones de hematoxilina utilizadas en la histología, la hematoxilina de Gill, la hematoxilina de Harris y la hematoxilina de Mayer son las más populares.
La eosina se forma por una reacción entre el bromo y la fluoresceína. Hay dos variantes de eosina que se utilizan habitualmente en histología: la eosina Y, que es ligeramente amarillenta, y la eosina B, que es ligeramente azulada. La eosina Y es la más popular.


Tinciones especiales
El término “tinciones especiales” hace referencia tradicionalmente a cualquier tinción que no sea una H&E. Abarca una amplia variedad de métodos que pueden utilizarse para visualizar estructuras tisulares particulares, elementos o incluso microorganismos no identificados mediante tinción H&E.
Otros métodos de tinción utilizan inmunohistoquímica o hibridación in situ para dirigirse a proteínas específicas o secuencias de DNA/RNA. Estos métodos a veces también se han incluido en la familia de “tinciones especiales”. Sin embargo, son bastante diferentes en cuanto al método y la finalidad, y ahora se separan normalmente en una tercera categoría conocida como “tinciones avanzadas”.
Aunque, literalmente, hay cientos de tinciones especiales para todo tipo de fines, solo unos pocos se utilizan con regularidad en histología clínica. La variedad de tinciones también hace que la tinción especial no esté tan automatizada como la tinción H&E. Aunque muchos laboratorios de gran tamaño utilizan instrumentos automatizados para las tinciones más comunes, siguen teniendo un área para la tinción manual. La complejidad de algunas tinciones también impide el uso de la automatización.
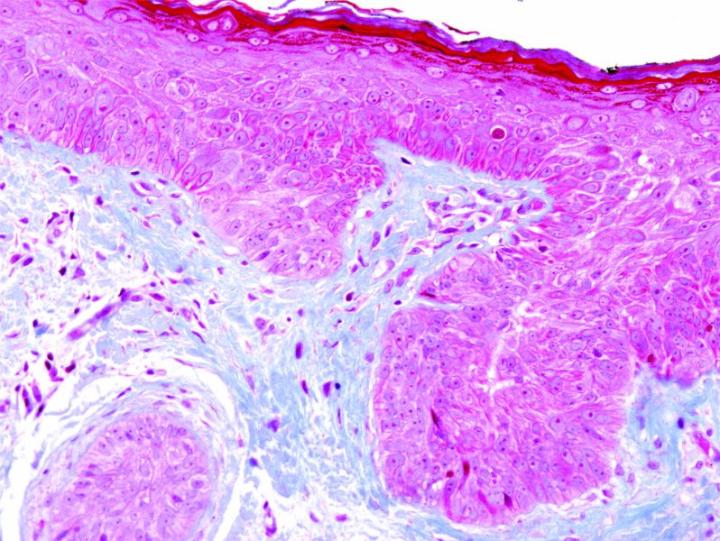
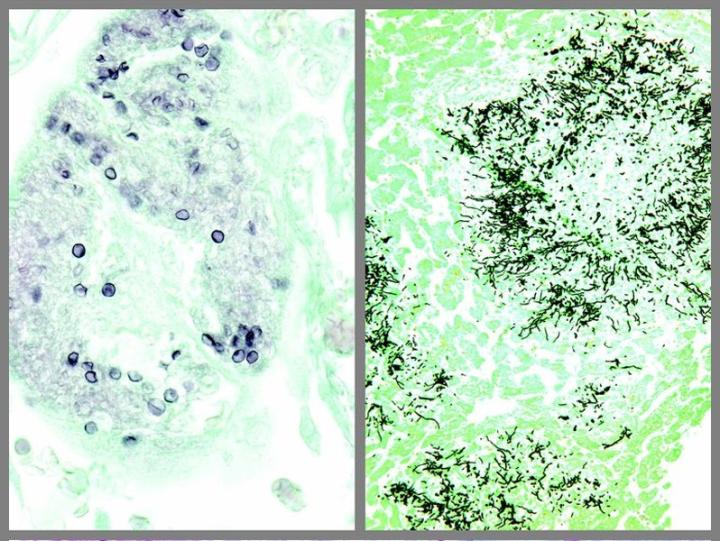
Algunas tinciones especiales comunes
Las imágenes siguientes ilustran algunas de las tinciones especiales comunes y sus aplicaciones.
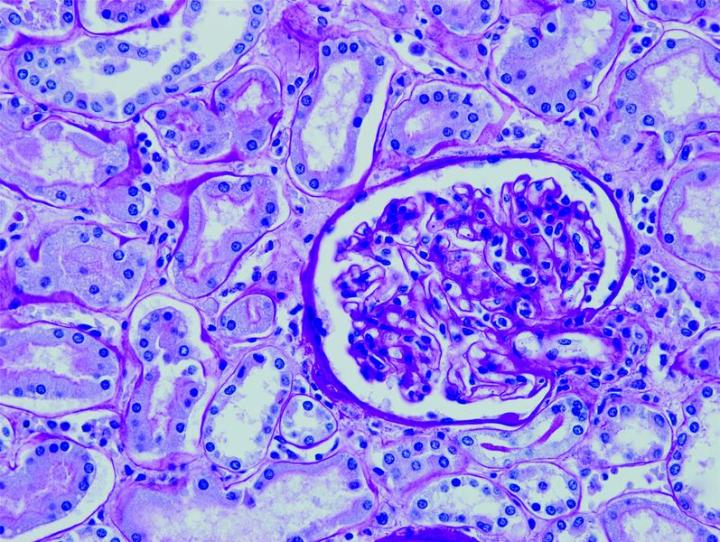


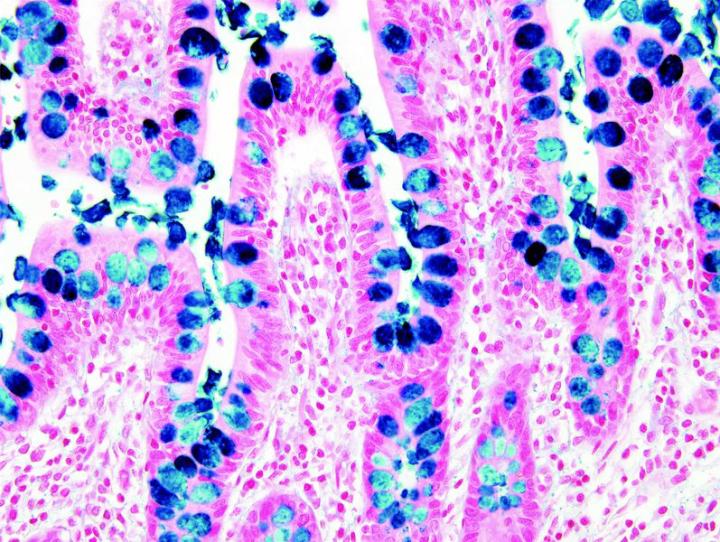
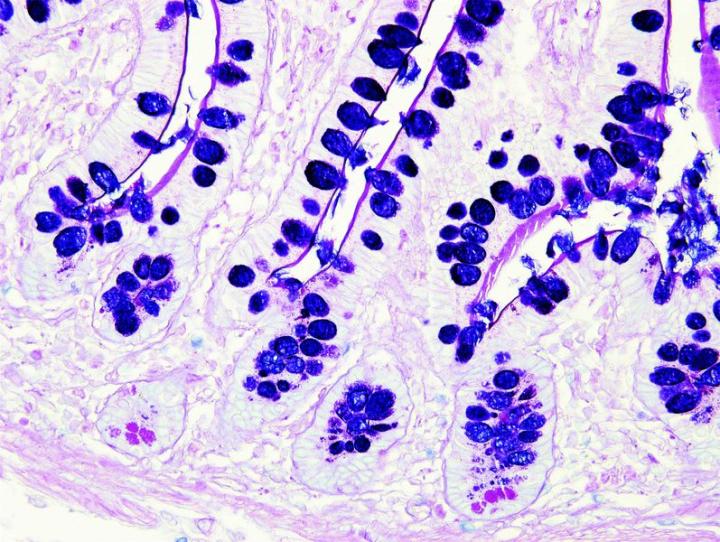
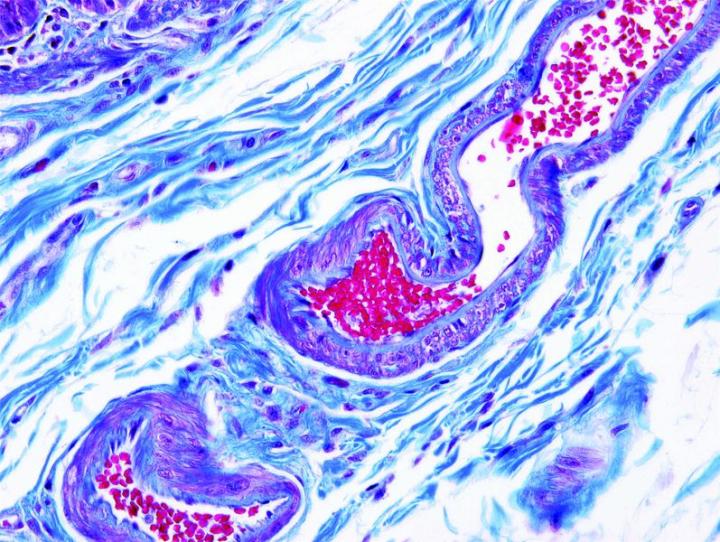

Pasos para obtener mejores tinciones especiales
En Leica Biosystems, nuestra visión es avanzar en el diagnóstico del cáncer y mejorar la vida de las personas. Una forma de lograr esta visión es ayudando a mejorar la calidad de la tinción. Puesto que reconocemos que la calidad de la IHC y la ISH no comienza en la estación de tinción, esta serie examina muchos aspectos diferentes de la calidad de la tinción y analiza cómo influirán las pruebas futuras en un mejor diagnóstico.
Comprender la tinción
Sepa qué está intentando demostrar con la tinción que está realizando.
El simple hecho de “seguir el método” y no saber realmente lo que se debe ver en la sección terminada dará lugar a malos resultados.

Usar un control positivo
Utilice siempre una preparación de control que contenga la estructura/sustancia que está intentando demostrar.
“Si la estructura/sustancia para la que estamos tiñendo no es visible en una preparación, suponemos que no está presente”.

Usar un tiempo preciso
Use un tiempo preciso.
El tiempo siempre es aproximado. Una temporización imprecisa produce resultados incoherentes.

Considerar la estabilidad de los reactivos
Tenga en cuenta la vida útil de los reactivos que está utilizando. Algunos reactivos o soluciones de tinte se deterioran lentamente, mientras que otros son muy inestables y deben prepararse frescos y utilizarse inmediatamente. Hay que dejar que otros se oxiden (maduren) durante algún tiempo antes de poder usarlos.
Asumimos que todos los reactivos pueden utilizarse durante un periodo indefinido.

Almacenar los reactivos correctamente
Almacenar los reactivos correctamente. Algunos requieren refrigeración porque tienden a soportar el crecimiento de hongos o moho. Otros son sensibles a la luz y requieren un almacenamiento en la oscuridad.
“Todos nuestros reactivos se almacenan en el estante situado encima del banco de tinción. A veces vemos organismos extraviados en nuestras secciones”.

Respetar el método
Siga exactamente el protocolo.
Los miembros del personal obtienen diferentes resultados aunque usen supuestamente el mismo protocolo.

Registrar cualquier cambio
Documente cualquier desviación del método que esté utilizando.
A veces, cuando los resultados son malos, es difícil o imposible averiguar por qué no se han registrado los cambios en el protocolo.

Estandarizar los pasos de lavado
Tenga especial cuidado con los pasos de lavado. Estandarícelos tanto como sea posible, ya que son con frecuencia la causa de resultados variables.
Los miembros del personal del laboratorio utilizan diferentes técnicas de lavado: algunos utilizan una agitación enérgica, otros son mucho más suaves.

Preparar el microscopio cuidadosamente
Utilice el control microscópico en etapas cruciales, como los pasos de diferenciación. Tenga en cuenta el efecto de la configuración del microscopio sobre el aspecto de las secciones sin cubreobjetos (húmedas); puede producir el aspecto de una tinción de fondo falsa.
Para todos los métodos, el nivel de tinción se evalúa mirando la preparación a simple vista.
About the presenters

James Anderson is a Global Marketing Manager at Leica Biosystems with experience with histology and scientific, technical, and marketing communications.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.