
Übersicht H&E-Färbung: Ein Leitfaden zur guten Praxis


In der Routinediagnostik ist die Färbung mit Hämatoxylin und Eosin (H&E) die am häufigsten eingesetzte Methode zur Bewertung von Zell- und Gewebestrukturen durch Pathologen. Variationen in der Färbeintensität hängen häufig von der Erfahrung und den persönlichen Präferenzen des Pathologen ab. Da sich mithilfe dieser Färbung ein außerordentlich breites Spektrum an zytoplasmatischen und nukleären Merkmalen sowie Charakteristika der extrazellulären Matrix zeigen lassen, finden sich H&E-Bilder in nahezu allen Lehrbüchern. Diese einfache Färbung, die seit über einem Jahrhundert unverändert geblieben ist, ist auch heute noch unentbehrlich.
Die H&E-Färbung folgt einem grundlegenden Protokoll:
- Entwachsen
- Entwässerung
- Hämatoxylin
- Differenzierung
- Bläuung
- Eosin
- Entwässerung
- Klärung
- Eindecken
Das Protokoll lässt sich mühelos auf eine größere Anzahl von Objektträgern anwenden und auch die Reagenzien sind stabil genug, um zahlreiche Färbungen gleichbleibend hoher Qualität zu liefern, bevor sie gewechselt werden müssen.
In der Vergangenheit wurden Färbemittel und ihre Komponenten routinemäßig von den Laboren hergestellt. Kommerziell erhältliche, vorgefertigte Reagenzien waren teuer und damit nur selten verfügbar. Der Wirtschaftlichkeit halber erlernten die Techniker, die Farbstoffe für die H&E-Färbung nach Bedarf selbst herzustellen. Die Herausforderung bestand darin, eine gleichbleibende Färbequalität sicherzustellen. Verschiedene Techniker neigen dazu, ihrem eigenen individuellen Ansatz zu folgen, sodass Unterschiede in der Qualität der Färbungen vorprogrammiert waren, selbst wenn man mit demselben Rezept arbeitete. Deshalb wurde die Herstellung von Farbstoffen in der Regel nur einer Person überlassen. Davon einmal abgesehen arbeiteten in einem durchschnittlichen Labor mehr Techniker als heute und der zeitliche Aufwand zur Herstellung der Färbungen war Teil der kalkulierten Arbeitslast.
Heute geht man in aller Regel von der Prämisse aus, dass die Bestellung von Färbemitteln und Kits der einfachste Weg sei, um eine gleichbleibende Qualität und reproduzierbare Ergebnisse zu gewährleisten. Heute kann aus einer Vielzahl von Hämatoxylin- und Eosinfarbstoffen gewählt werden. Sie lassen sich nach den Ansprüchen des eigenen Labors kombinieren, wodurch maßgeschneiderte Färbeergebnisse mit geringem Aufwand zu erreichen sind. Vor dem Hintergrund von Personalmangel und -abbau kommt kommerziell erhältlichen Reagenzien eine noch größere Bedeutung zu. Sie erlauben es den Technikern, sich auf das Einbetten und Schneiden zu konzentrieren, was jene Aufgaben sind, die den geringsten Automatisierungsgrad aufweisen.
Wer heute eine Karriere im Bereich der Histologie startet, für den gehört die Herstellung von Reagenzien wohl der Vergangenheit an. Meiner Meinung nach ist dieser Wandel nicht unproblematisch, in erster Linie, weil etwas von der Kunst, die die Histologie ausmacht, verloren geht. Wenn ich mit Studenten arbeite, sehe ich es als persönliche Herausforderung an, ihnen das Handwerkszeug zu vermitteln, die Ursachen von Färbeanomalien zu identifizieren und zu beheben. Wenn Färbungen vom Labor selbst hergestellt werden, lernt das Team aus eigener Erfahrung, was passiert, wenn vom Protokoll abgewichen wird, z. B. wenn eine Komponente fehlt oder an falscher Stelle hinzugefügt wird. Daraus können sich mehr oder weniger offensichtliche Fehler in den gefärbten Objektträgern ergeben, bei denen erwartet wird, dass die Histologieabteilung sie lösen kann. Letztendlich passiert es, dass jüngere Mitarbeiter vor Fehlern kapitulieren müssen, die leicht zu beheben wären, weil es ihnen schlicht an Erfahrung mit der Herstellung von Reagenzien und den in diesem Prozess gewonnenen Erkenntnissen mangelt.
Was steckt in einer H&E-Färbung?
H&E-Färbungen kommen in vielen Bereichen des histologischen Labors zum Einsatz, beispielsweise bei der Arbeit mit Gefrierschnitten, Feinnadelaspiraten und in Paraffin fixiertem, eingebetteten Gewebe. Um besser zu verstehen, was einen gut gefärbten Objektträger ausmacht, ist es unabdingbar, die Komponenten der Färbung zu kennen.
Hämatoxylin wird verwendet, um nukleäre Details zu veranschaulichen. Die Tiefe der Färbung hängt nicht nur mit der Menge an DNA in den Zellkernen zusammen, sondern auch mit der Zeit, die die Probe in Hämatoxylin belassen wird.
Hämatoxylin ist ein relativ einfach herzustellendes Färbemittel. Der Farbstoff selbst wird aus dem Blauholzbaum Haematoxylum campechianum extrahiert. Die Oxidation des Hämatoxylins ergibt Hämatein, welches der eigentliche Farbstoff ist, der in einer H&E-Färbung Verwendung findet. Die Zugabe eines Beizmittels erhöht die Kapazität des Hämateins zur Bindung an anionische, also negativ geladene Gewebekomponenten.
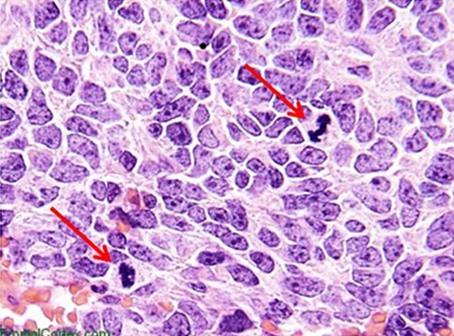
Hämatoxyline werden typischerweise nach den ihnen zugesetzten Beizmitteln klassifiziert. Diese erhöhen die positive Ladung des Hämateins und damit stärken sie die Bindung des Farbstoffs an anionische Strukturen, vor allem an Chromatin. Die Art des Beizmittels beeinflusst auch die endgültige Farbe der angefärbten Gewebekomponenten. Das in der Routinehistologie am häufigsten verwendete Beizmittel ist Aluminiumammoniumsulfat, das auch Alum oder Alaun genannt wird. Dieses Beizmittel bewirkt eine Rotfärbung des Kerns, die ins vertrautere Blau wechselt, wenn die Probe später mit einer schwach basischen Lösung gespült wird.
Mayers Hämatoxylin ist ein Alaun-Hämatoxylin, ein häufig verwendetes Färbmittel, das sowohl für progressive als auch für regressive Färbungen verwendet werden kann. Im Rahmen von Spezialfärbungen und immunhistochemischen Färbungen wird es oft zur Gegenfärbung der Zellkerne genutzt. Dabei geht es um eine Zellkernfärbung und -bläuung ohne Differenzierung. Mayers Hämatoxylin ist ein Färbemittel auf Wasserbasis.
Harris Hämatoxylin ist ein weiteres, häufig genutztes Alaun-Hämatoxylin, das für die progressive Färbung von zytologischen Proben verwendet werden kann, aber auch für progressive und regressive Färbungen in der Histologie. Die Färbung zeichnet sich durch besonders klare Details in den Zellkernen aus. Bei der Verwendung von Harris Hämatoxylin ist zu beachten, dass es im Idealfall mit einer schwachen Säure zu differenzieren ist, während üblicherweise mit Salzsäure-Ethanol gearbeitet wird. Harris Hämatoxylin ist ein Farbstoff auf Alkoholbasis. Ähnlich wie die beiden zuvor beschriebenen Produkte zählt auch Gills Hämatoxylin zu den Alaun-Hämatoxylinen. Es kann zur progressiven oder regressiven Färbung benutzt werden und ist in verschiedenen Konzentrationen erhältlich. Die Herstellung mit Wasser und Ethylenglykol beugt einer Autoxidation über Monate vor, wodurch Gills stabiler ist als Harris Hämatoxylin. Aufgrund der Beschaffenheit von Gills Hämatoxylin kann es jedoch zur Anfärbung von extranukleären Strukturen kommen. Muzin und sogar Klebstoffe, die sich auf dem Objektträger befinden, können stark kontaminiert werden.
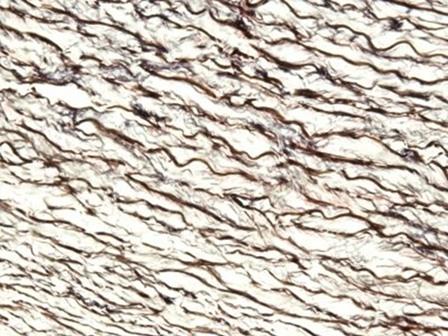
Die Hämatoxyline, die mit Eisensalzen gebeizt werden, finden typischerweise in Spezialfärbungen Anwendung. Das liegt daran, dass sie die Darstellung zusätzlicher Gewebestrukturen erlauben, wie beispielsweise Myelin und elastische Fasern. Eines der bekanntesten Hämatoxyline aus dieser Gruppe ist das Hämatoxylin nach Weigert, das in der Verhöff-van-Gieson-Färbung verwendet wird, wie sie in Abb. 6 dargestellt ist.
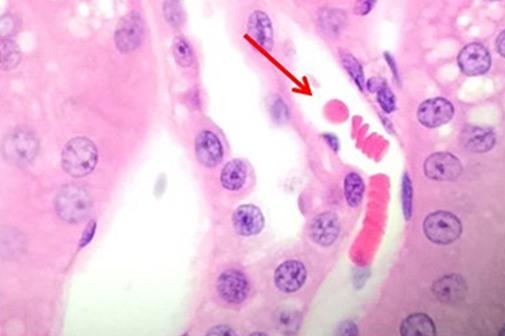
Nachdem wir die Kernfärbungen diskutiert haben, wollen wir nun zu den Möglichkeiten zur Färbung der zytoplasmatischen Komponenten kommen. Eosin ist die am häufigsten verwendete Gegenfärbung, die den Kontrast zwischen Zytoplasma und Zellkernen erhöht. Mit Eosin angefärbte Elemente stellen sich in der Regel rosa dar, wobei die Farbpalette verschiedene Schattierungen umfasst, wie sie u. a. in Proben mit unterschiedlichen Bindegewebsfasern deutlich werden.
Eosin Y ist die am häufigsten genutzte Eosinvariante und kann sowohl in Wasser als auch in Alkohol verwendet werden. Die Zugabe einer geringen Menge Essigsäure bewirkt eine erhöhte Detailschärfe. Eosin-Phloxin-Lösungen verstärken den Rotanteil der H&E- Färbung. Diejenigen Anwender, die eine kräftige Rotfärbung suchen, können dem Eosin also Phloxin hinzufügen.
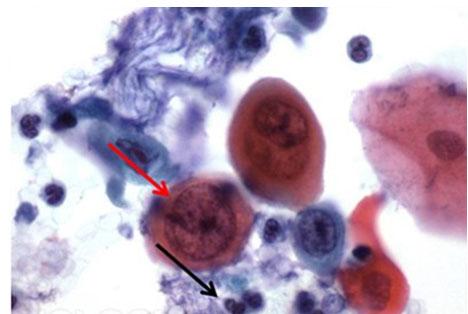
Manchmal werden auch andere Eosin-Lösungen verwendet, wie EA50 und EA65. Hierbei handelt es sich um Polychromlösungen, die hauptsächlich in der Zytologie genutzt werden und neben Eosin Y Lichtgrün und Bismarckbraun enthalten. Der Zusatz dieser beiden Farbstoffe sorgt für die Farbvariationen des Zytoplasmas, die von blassblau bis rosa reichen, und am besten vom Plattenepithel in Pap-Abstrichen bekannt ist. Die Konzentration der Mischung entscheidet über die Bezeichnung als EA50 oder EA65.
Die Differenzierung von Färbungen ermöglicht es, Farbstoffe selektiv von bestimmten Gewebestrukturen zu entfernen. Im Fall von Hämatoxylin werden zur Differenzierung vor allem Salzsäure (für eine schnelle Differenzierung) und Essigsäure (für eine langsamere, kontrolliertere Differenzierung) verwendet. Während Salzsäure in der Vergangenheit der Standard war, werden heute schwächere Säuren bevorzugt, die eine schonendere Entfernung der Farbstoffe ermöglichen. Das liegt auch an der zunehmenden Automatisierung der Färbungen, wobei neben der Zeit, die eine Probe in ein Reagens getaucht ist, die Bewegung des Roboterarms berücksichtigt werden muss.
Bläuungsreagenzien, wie z. B. Scott'sche Lösung, werden verwendet, um einen Farbumschlag von Rot zu Blau zu induzieren, jenem Farbton, den wir von der H&E-Färbung erwarten. Diese leicht basischen Lösungen bewirken eine chemische Veränderung des Farbstoffs und erzeugen so den Farbwechsel. An einigen Orten enthält das Leitungswasser so viele Mineralstoffe, dass sein pH-Wert hoch genug ist, um mit ihm Kerne bläuen zu können, ohne dass ein Bläuungsreagens erforderlich wäre. In den meisten Fällen umfassen die Protokolle aber einen standardisierten Bläuungsschritt, um ein angemessenes Bläuen zu gewährleisten.
Damit haben wir alle Komponenten dieser Standardfärbung erfasst, die den größten Teil histologischer Färbungen ausmacht.
Auswahl eines geeigneten Protokolls für die H&E-Färbung
Der nächste Schritt auf dem Weg zu einem optimalen Färbeergebnis ist die Entscheidung, welche Art von H&E-Färbung gebraucht wird. Typischerweise werden drei Arten von H&E-Färbungen unterschieden: die progressive, die modifiziert progressive und die regressive.
Von einer progressiven Färbung wird gesprochen, wenn das Gewebe mit Hämatoxylin gefärbt wird, ohne dass eine anschließende Differenzierung zur Entfernung von überschüssigem Farbstoff erfolgt. Da kein besonderer Differenzierungsschritt realisiert wird, kann es zur Hintergrundfärbung kommen, insbesondere bei der Verwendung von geladenen oder vorbehandelten Objektträgern. Dieses Vorgehen ist für bestimmte Situationen zu empfehlen, in denen nicht-zelluläres Material dargestellt werden soll, wie beispielsweise Muzin. Die Anfärbbarkeit extrazellulärer Elemente kann auch als Indikator für gut differenzierte Tumoren dienen.
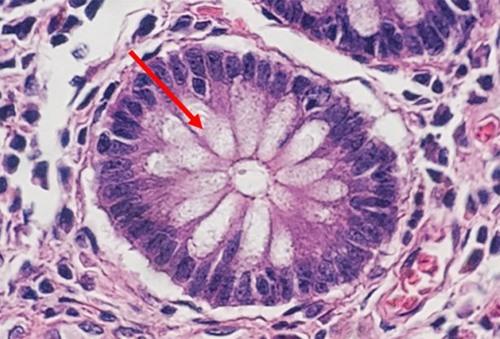
Schauen wir uns zunächst ein Protokoll für eine einfache regressive Färbung an, die ein ausgewogenes Verhältnis von Kern- und zytoplasmatischen Färbungen ermöglicht. Für dieses Protokoll ist eine Differenzierung mit einer schwachen Säure vorgesehen.
Nach Auswahl der benötigten Färbemittel empfiehlt es sich, sich zunächst an das Basisprotokoll zur H&E-Färbung zu halten. Von hier aus können Sie dann die Hämatoxylinzeiten in 30-Sekunden-Schritten ODER die Eosinzeiten in 15-Sekunden-Schritten anpassen. Denken Sie daran, dass Eosin die Probe wesentlich schneller durchdringt. Sofern keine Notwendigkeit besteht, die Intensität der Eosinfärbung deutlich zu erhöhen oder zu reduzieren, ist es ratsam, Anpassungen in kleinen Schritten vorzunehmen. Drehen Sie an nur einer Stellschraube zur gleichen Zeit und verändern Sie Hämatoxylin- und Eosinzeiten nicht auf einmal. Es mag den Anschein erwecken, dass das Hämatoxylin überfärbt, während es nur einer geringen Verstärkung des Eosins bedarf.
In Anbetracht des stetig zunehmenden Bedarfs für histologische Diagnosen darf die Kontinuität von Qualität und Durchsatz nicht dem Zufall überlassen werden. Dabei ist die Reproduzierbarkeit eines der wichtigsten Qualitätsmerkmale von Färbungen. Bei der manuellen Färbung können menschliche Faktoren dazu führen, dass die Objektträger aus einem Rack anders gefärbt werden als die Proben aus der nächsten Charge. Die Umstellung auf automatisierte Prozesse mindert nicht nur das Potenzial für derartige Inkonsistenzen, sondern schafft auch Freiräume, in denen sich die Techniker anderen Aufgaben zuwenden können.
Es ist wichtig, dass bezüglich der Farbstoffe das richtige Gleichgewicht erreicht wird. Eine Überfärbung mit Hämatoxylin kann den Eindruck einer Unterfärbung mit Eosin vermitteln, ebenso wie eine Überfärbung mit Eosin dazu führen kann, dass das Hämatoxylin schwächer erscheint, als es tatsächlich ist. Achten Sie deshalb bei der Optimierung der Färbung darauf, in einem Ansatz allein die Hämatoxylin- oder Eosinzeit anzupassen. So sparen Sie sich den Aufwand, herauszufinden, welche Änderung im Protokoll zum Erfolg geführt hat – oder auch nicht.
| Xylol | 2 Minuten |
| Xylol | 2 Minuten |
| Ethanol 100 % | 2 Minuten |
| Ethanol 100 % | 2 Minuten |
| Ethanol 95 % | 2 Minuten |
| Mit Wasser waschen | 2 Minuten |
| Hämatoxylin | 3 Minuten |
| Mit Wasser waschen | 1 Minute |
| Differenzierung (schwache Säure) | 1 Minute |
| Mit Wasser waschen | 1 Minute |
| Bläuung | 1 Minute |
| Mit Wasser waschen | 1 Minute |
| Ethanol 95 % | 1 Minute |
| Eosin | 45 Sekunden |
| Ethanol 95 % | 1 Minute |
| Ethanol 100 % | 1 Minute |
| Ethanol 100 % | 1 Minute |
| Xylol | 2 Minuten |
| Xylol | 2 Minuten |
| Eindecken |
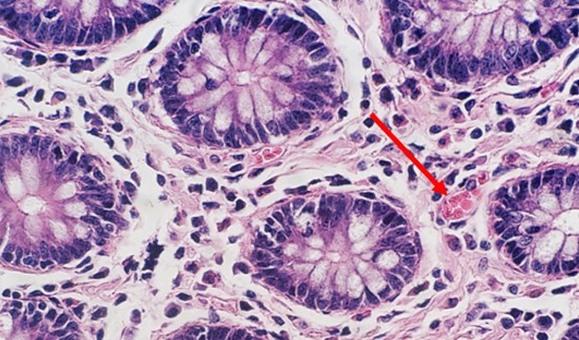
In der regressiven und modifiziert progressiven Färbung wird differenziert. Wird das Differenzierungsmittel im eigenen Labor gemischt, besteht das Risiko, dass es entweder zu schwach oder zu stark wirkt. Beide Szenarien würden sich nachteilig auf die Färbung auswirken: Bei zu starker Differenzierung etwa wird mehr Hämatoxylin entfernt als beabsichtigt, was die Zellkerne blass aussehen lässt. Die Zeit ist ein weiterer wichtiger Faktor. Zu viel Zeit in einem angemessen gemischten Differenzierungsmittel kann einen ähnlichen Effekt erzeugen, weil ebenfalls mehr Hämatoxylin entfernt und der Zellkern letztlich unterfärbt wird.
Die Haltbarkeit von Hämatoxylin wird entscheidend verlängert, wenn die Lösung leicht sauer ist. Andernfalls bewirkt die Alkalinität des Leitungswassers eine derartige Erhöhung des pH-Werts, dass der Farbstoff präzipitiert und seine Farbe von Kirschrot zu Purpurrot umschlägt. Das regelmäßige Hinzufügen geringer Mengen Essigsäure zum Hämatoxylin hilft, den pH-Wert niedrig zu halten und kann die Haltbarkeit des Färbemittels deutlich verlängern.
Wasser wird als Differenzierungsmittel für Eosin verwendet. In diesem Kontext ist es üblich, der Behandlung mit Eosin mit 95%igem Ethanol zu folgen. Das Ethanol hilft beim Spülen des Objektträgers, während das Wasser überschüssiges Eosin aus dem Gewebe zieht. Dieser Schritt dient der Kontrolle der Färbeintensität. Allerdings ist zu berücksichtigen, dass eine allzu lange Exposition gegenüber 95%igem Ethanol für eine starke Aufhellung der Färbung sorgt; leuchtende Farben bleiben eher erhalten, wenn dieser Schritt verkürzt wird. Überschüssiges Wasser im Xylol kann den Differenzierungsprozess weiter verlängern, was sich nach dem Eindecken als rosa Dunst auf dem Objektträger zeigt.
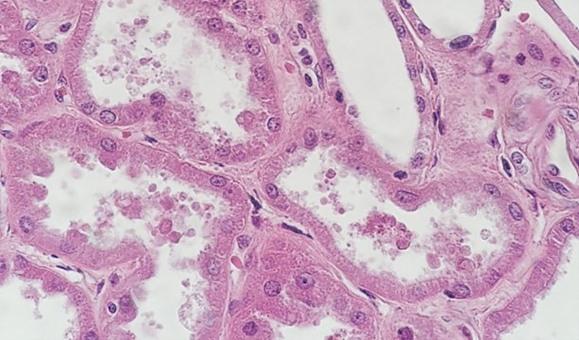
Nicht alle Gewebe sind gleich. Die Beurteilung von Zysten und fetthaltigen Geweben kann selbst bei korrekter Verarbeitung schwierig sein. Diese Proben beinhalten oft „leere“ Stellen, an denen sich Flüssigkeiten oder Fett befanden, und die dünnen Zellwände mögen den Anschein erwecken, dass das Präparat nur schwach gefärbt sei. Dabei handelt es sich schlicht um ein gewebeabhängiges Artefakt.
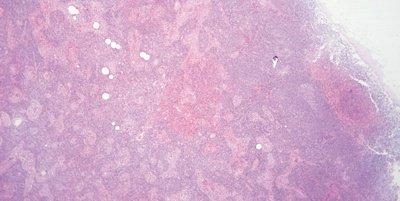
Proben mit hoher Zellularität, z. B. Tonsillen und Lymphknoten, können ebenfalls Kopfzerbrechen bereiten. Bevor Sie daran verzweifeln, erinnern Sie sich, dass Lymphozyten nur wenig Zytoplasma haben und dass die genannten Gewebe weniger Extrazellulärsubstanz haben als das bei anderen Geweben der Fall ist. Aus diesem Grund muss das Hämatoxylin hier nicht mit dem Eosin konkurrieren. Die kompakte Natur der Zellen führt weiterhin zu einer hohen DNA-Konzentration, sodass diese hochzellulären Gewebe häufig überfärbt erscheinen, obwohl sie in Wirklichkeit einfach nur dünner geschnitten werden müssen.
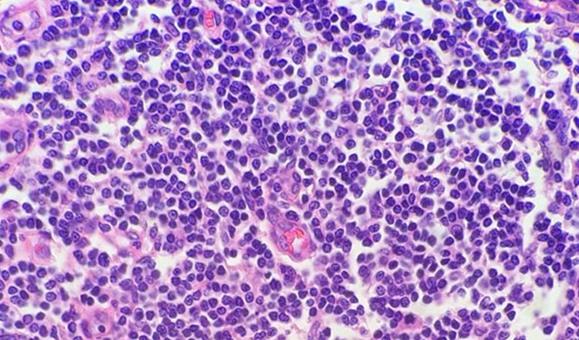
Die Verwendung von sauberen und frischen Entparaffinierungsreagenzien ist unerlässlich für die Entfernung von Paraffin vom Objektträger, bevor dieser gefärbt wird. Während Xylol das nach wie vor am häufigsten verwendete Lösungsmittel ist, gewinnen weniger toxische und umweltfreundlichere Ersatzstoffe an Popularität. Eine Verunreinigung des Lösungsmittels mit Wasser, sei es aufgrund einer Kontamination mit anderen Reagenzien oder einer hohen Luftfeuchtigkeit in der Umgebung, reduziert dessen Kapazität zum Paraffinentzug. Verbleibendes Paraffin wiederum behindert das Eindringen der Farbstoffe in das Gewebe, wodurch Unregelmäßigkeiten in der Färbung entstehen.
Der einfachste Weg, dies zu verhindern, ist, die Reagenzien regelmäßig zu erneuern. Durch die Zugabe einer kleinen Menge Trocknungsmittel (etwa ein Esslöffel pro Reagenzienbehälter) lässt sich die Wasserkontamination von Lösungsmitteln reduzieren. Diese Maßnahmen sind besonders wichtig, wenn Xylol-Ersatzstoffe verwendet werden, da diese in der Regel weit weniger tolerant gegenüber einer Wasserkontamination sind als Xylol selbst.
Schritt-für-Schritt-Anleitung zur Durchführung einer H&E-Färbung
Die H&E-Färbung ist die am häufigsten realisierte Färbung in histologischen und histopathologischen Laboratorien. Richtig ausgeführt schafft sie die notwendigen Voraussetzungen, eine breite Palette von normalen und pathologisch veränderten Zell- und Gewebekomponenten zu beurteilen. Ungeachtet ihrer Bedeutung handelt es sich um eine relativ einfache Färbung für Paraffin- und Gefrierschnitte. In der Histopathologie kann ein hoher Prozentsatz der Fälle von erfahrenen Pathologen diagnostiziert werden, auch wenn einzig und allein H&E-Präparate vorliegen.
Eine kleine Anzahl von Objektträgern kann effizient manuell gefärbt werden, während Labore mit hohem Durchsatz auf Färbeautomaten setzen, um den Anforderungen hinsichtlich Bearbeitungszeit und Qualität gerecht zu werden.
Es gibt verschiedene Hämatoxylin- und Eosin-Formulierungen, die im Laboralltag verwendet werden und die alle ihre jeweiligen Vor- und Nachteile haben. Einige Labore ziehen es vor, ihre eigenen Lösungen zuzubereiten, während andere sich für gebrauchsfertige, kommerziell erhältliche Produkte entscheiden.
Einleitung
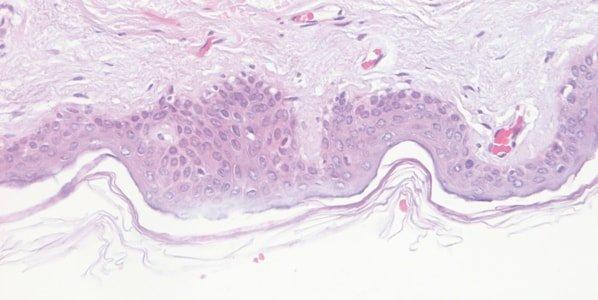
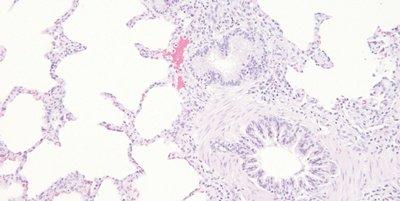
Die H&E-Färbung liefert ein umfassendes Bild der Mikroanatomie von Organen und Geweben. Hämatoxylin färbt nukleäre Bestandteile zuverlässig an, einschließlich des Heterochromatins und der Nukleoli, während Eosin an zytoplasmatische Komponenten, aber auch an Kollagen und elastische Fasern, Muskelfasern und Erythrozyten bindet. In einer qualitativ hochwertigen H&E-Färbung sind feine Unterschiede in den Farbtönen erkennbar, die auf die Bindung der Farbstoffe, insbesondere die des Eosins, zurückzuführen sind. Bei der Identifikation und Interpretation morphologischer Veränderungen sind sie außerordentlich wertvoll.
Es ist wichtig, dass jene Fachleute, die H&E-Färbungen vornehmen und in Bezug auf ihre Qualität bewerten, sich dieser subtilen Unterschiede bewusst sind und wissen, was möglich ist, wenn die Färbung ordnungsgemäß mit hochwertigen Reagenzien durchgeführt wird. Dazu müssen sie natürlich mit den mikroskopischen Korrelaten vertraut sein. Die Bereitstellung von gleichbleibend hochwertigen H&E-Färbungen ist ein elementarer Anspruch von Histologielaboren.
In den folgenden Abschnitten werden die grundlegenden Schritte zur Durchführung einer H&E-Färbung beschrieben.
Entwachsen
Nach der Präparation eines Paraffinschnitts sind sämtliche Gewebeelemente mit Paraffin infiltriert und von diesem umgeben, wobei das Wachs hydrophob und für wässrige Reagenzien undurchdringbar ist. Auf der anderen Seite sind die meisten Zell- und Gewebebestandteile nicht farbig und daher ohne selektive Darstellung nicht zu beurteilen. Der erste Schritt in der H&E-Färbung besteht also darin, das Wachs mit Xylol, einem Kohlenwasserstofflösemittel, auszulösen.
Rehydrierung
Nach gründlicher Entparaffinierung durchläuft der Objektträger eine absteigende Alkoholreihe, um seinerseits das Xylol zu entfernen. Danach wird er gründlich mit Wasser gespült. Der Schnitt ist nun rehydriert und kann von wässrigen Reagenzien problemlos durchdrungen werden.
Hämatoxylin-Kernfärbung
Der Objektträger wird nun mit einem Kernfarbstoff wie Harris Hämatoxylin gefärbt, das aus einem Farbstoff (oxidiertes Hämatoxylin oder Hämatein) und einem Beiz- oder bindenden Mittel (einem Aluminiumsalz) in Lösung besteht. Zunächst färben sich die Kerne und einige andere Elemente rötlich-lila.
Bläuen
Nach einem Waschschritt mit Leitungswasser wird der Schnitt durch die Behandlung mit einer schwach alkalischen Lösung „gebläut“. Dieser Schritt gibt dem Hämatoxylin seine dunkelblaue Farbe. Der Schnitt kann nun abgespült und hinsichtlich der Kernfärbung überprüft werden. Dabei ist zu kontrollieren, ob die Nuklei einen angemessenen Kontrast aufweisen und ob die Hintergrundfärbung vertretbar ist.
Differenzierung
Bei Verwendung von Harris Hämatoxylin ist in der Regel ein Differenzierungsschritt, also eine Entfärbung, erforderlich, um die unspezifische Hintergrundfärbung zu reduzieren und den Kontrast zu verbessern. Dazu wird schwach saurer Alkohol verwendet. Nach dieser Behandlung werden eine erneute Bläuung und gründliches Waschen notwendig. Färbemethoden, die einen solchen Schritt zur Entfärbung oder Differenzierung beinhalten, werden als regressive Färbungen bezeichnet.
Eosin-Gegenfärbung
Der Schnitt wird jetzt mit einer Wasser- oder Alkohol-basierten Eosinlösung gefärbt, je nach persönlichen Vorzügen. Dabei färben sich zahlreiche nicht-nukleäre Elemente in verschiedenen Rosatönen.
Spülen, entwässern, klären und eindecken
Nach der Eosinfärbung wird der Objektträger durch eine aufsteigende Alkoholreihe geführt, um sämtliches Wasser zu entfernen, und dann in Xylol geklärt, wobei das Gewebe vollständig transparent wird. Eine dünne Schicht aus Eindeckmedium ist aufzutragen, bevor das Deckglas auf den Objektträger gesetzt wird. Wenn die Färbung und alle nachfolgenden Schritte ordnungsgemäß durchgeführt wurden, sind die entscheidenden Gewebe- und Zellbestandteile im Präparat erkennbar und bleiben es über mehrere Jahre.
Fehlerbehebung bei H&E-Färbungen
Obwohl die H&E-Färbung eine relativ einfache Färbung ist, kann es zur Bildung von unterschiedlichen Artefakten kommen, die das Ergebnis stören.
Artefakte können auf verschiedene Ursachen zurückzuführen sein.
Schritte zur besseren Routinefärbung und zum richtigen Eindecken
Auf ihrem Weg vom Patienten zum Pathologen erfordert die Vorbereitung einer Gewebeprobe für die histologische Untersuchung Sorgfalt, Geschick und verlässliche Verfahren. Dieser Leitfaden gibt praktische Ratschläge zu bewährten Methoden und erklärt, wie häufige Fehler vermieden werden können.
In diesem Artikel liegt der Fokus auf Tipps für bessere Ergebnisse in der Routinefärbung und beim Eindecken. Wir hoffen, dass die einzelnen Schritte helfen, die gute histologische Praxis in Erinnerung zu rufen, und dass sie die Fehlersuche vereinfachen, wenn die Ergebnisse mal nicht zufriedenstellend sein sollten.
Möchten Sie alle 101 Schritte zu einer besseren Histologie sehen?
Klicken Sie hier, um sie noch heute herunterzuladen!
Schritt 52 - Zeitliche Vorgaben einhalten
Jeder Schritt des Färbeprotokolls ist zeitlich genau festgelegt.
Färbezeiten sind nur ungefähr festgelegt. Wenn die Bearbeitung eines Präparats eilt, werden Schritte übersprungen. Das kann zu inkonsistenten, wenig aussagekräftigen Ergebnissen führen.

Schritt 53 - Qualität der Färbung prüfen
Um die Färbequalität zu kontrollieren, werden regelmäßig Kontrollpräparate mitgeführt und gefärbt.
Insbesondere für H&E-Färbungen werden Qualitätskontrollen übergangen. Bei Problemen mit der Färbung ist es deshalb nur schwer möglich, zu unterscheiden, ob diese auf eine mangelhafte Qualität der Reagenzien, ein ungeeignetes Protokoll oder eine schlechte Fixierung zurückzuführen sind.
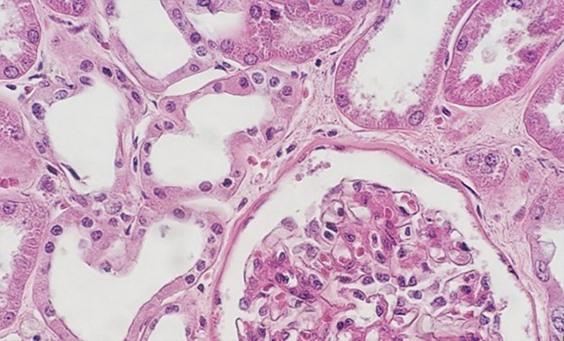
Schritt 54 - Färbebedingungen standardisieren
Rühr-, Wasch- und Abtropfzeiten sind für alle Schritte beim Färben optimiert und festgeschrieben.
Rühr-, Wasch- und Abtropfzeiten variieren. Lösungsmittel und Reagenzien werden schnell verunreinigt. Damit werden die Färbeergebnisse inkonsistent und verlieren an Aussagekraft.

Schritt 55 - Vollständige Entparaffinierung sicherstellen
Die Entparaffinierung der Präparate erfolgt unter optimalen Bedingungen und vollständig.
Die Entparaffinierung der Schnitte erfolgt nicht immer vollständig, sodass sich auf den Objektträgern Flecken mit Wachsresten finden. In diesen Bereichen kommt es zu Problemen bei der Färbung, die unzureichend oder unregelmäßig bleibt.
Schritt 56 - Reagenzien regelmäßig erneuern
Lösungsmittel und Färbereagenzien werden regelmäßig ausgetauscht. Die Entscheidung, wann ein Wechsel erforderlich ist, wird auf Grundlage der Anzahl der gefärbten Objektträger oder der bearbeiteten Racks gefällt.
Die Erneuerung von Lösungsmitteln und Färbereagenzien erfolgt planlos. Sie werden erst ersetzt, wenn die Färbequalität sichtbar nachlässt.
Schritt 57 - Schnitte gründlich rehydrieren
Die Präparate werden vor der Hämatoxylin-Färbung gründlich rehydriert.
Es kommt immer wieder zur Kontamination der Hämatoxylin-Lösung mit Alkohol oder Xylol. Daraus resultiert eine ungleichmäßige Färbung.
Schritt 58 - Qualität der Hämatoxylin-Lösung kontrollieren
Die Qualität der Hämatoxylin-Lösung wird sorgfältig überwacht: Während ihrer Nutzungsdauer wird sie zwangsläufig verdünnt, weil es zur Verschleppung anderer Reagenzien von Objektträgern und Racks kommt. Weitere Qualitätseinbußen ergeben sich aus unvermeidbaren Oxidationsprozessen. Deshalb müssen die Färbeergebnisse kontinuierlich evaluiert werden.
Es werden variable, nicht reproduzierbare Färbeergebnisse erzielt, für die keine Erklärung gesucht wird. So können z. B. die Oberflächen des Färbebads, die Belüftung während der Färbung und die Umgebungstemperatur die Oxidation der Lösung beeinflussen.
Schritt 59 - Vollständiges Bläuen der Zellkerne sichern
Nach der Hämatoxylin-Färbung werden Scott’sche Lösung oder Ammoniakwasser eingesetzt, um ein gründliches Bläuen der Zellkerne zu gewährleisten. Die spezifischen Anforderungen hängen vom pH-Wert des Leitungswassers ab, das vor Ort verfügbar ist.
Weil das Bläuen der Zellkerne nur unzureichend erfolgt, erscheinen diese auch in fertigen Präparaten rosa oder rötlich. Auch eine Unterfärbung mit Hämatoxylin (oder Überdifferenzierung) und anschließende Überfärbung mit Eosin resultiert in rosaroten Zellkernen.

Schritt 60 - Gleichmäßige Eosin-Färbung begünstigen
Nach dem Bläuen wird gründlich in Leitungswasser gewaschen, um Reste alkalischer Lösungen zu entfernen, die die Eosin-Färbung behindern und zur schwachen und ungleichmäßigen Färbung führen können.
Ineffizientes Waschen nach dem Bläuen bedeutet, dass Alkalireste im Präparat verbleiben. Das stört die Eosin-Färbung.
Schritt 61 - pH-Wert der Eosin-Lösung kontrollieren
Der pH-Wert der Eosin-Lösung wird überwacht. Er wird um pH 5,0 gehalten, um optimale Färbeergebnisse zu ermöglichen. Die Zugabe von ein paar Tropfen Essigsäure genügt in der Regel, um die Lösung anzusäuern, wenn der pH-Wert zu hoch ist.
Es werden keine Anstrengungen unternommen, den pH-Wert der Eosin-Lösung zu kontrollieren und gegebenenfalls zu korrigieren. Weil es durch die Verschleppung von alkalischer Lösung zum Anstieg des pH-Werts der Eosin-Lösung kommt, leidet die Färbequalität. Eingegriffen wird erst, wenn die Färbeintensität nachlässt.
Schritt 62 - Vor Klärung und Eindecken gründlich dehydrieren
Die Schnitte werden gründlich entwässert, bevor sie zur Klärung in Xylol gelegt werden.
Um Zeit zu sparen, werden die Schnitte durch die Alkoholreihe gehetzt und in Xylol gegeben, bevor sie ausreichend entwässert sind. Bei Klärung in mit Wasser kontaminiertem Xylol können sich winzige Wassertröpfchen ins Gewebe einlagern, die mikroskopisch als undurchsichtige, detailarme Bereiche imponieren.
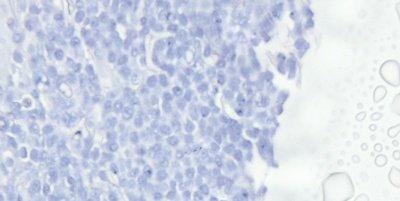
Schritt 63 - Austrocknen und Kristallbildung vermeiden
Das Deckglas wird stets aufgelegt, bevor der Schnitt trocknen kann, und es wird ein hochwertiges Eindeckmedium verwendet. Man weiß, wie sich das Einbettungsmedium bei längerer Lagerung verhält. Besonders in minderwertigen Medien können sich Kristalle bilden, manchmal erst nach Monaten oder Jahren.
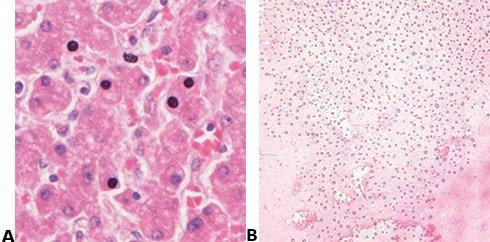
Man lässt die Schnitte teilweise trocknen, bevor das Deckglas aufgelegt wird, wodurch einige Zellkerne schwarz erscheinen. Allein aufgrund des Preises ausgewähltes Eindeckmedium kann bei langfristiger Lagerung Kristalle bilden und die Deckgläser können sich abheben.
Dieses Referenzdokument wird von Leica Biosystems als Service für medizinisches Fachpersonal angeboten und wurde auf Grundlage der verfügbaren Literatur zusammengestellt. Obwohl alle Anstrengungen unternommen wurden, um sicherzustellen, dass die hier aufgeführten Informationen zutreffend sind, kann Leica Biosystems nicht für deren Richtigkeit verantwortlich gemacht werden. Dieses Dokument ist nicht als medizinischer Rat gedacht und sollte auch nicht als solcher Verwendung finden. Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden. Leica Biosystems und die Herausgeber schließen jegliche Haftung für Schäden, die direkt oder indirekt aus der Benutzung der in diesem Referenzdokument beschriebenen Medikamente, Geräten, Techniken oder Verfahren entstehen, aus.
About the presenters

Cindy Sampias is a board certified Cyto- and Histo-technologist. With more than 25 years of experience, she is a guest speaker at histology and cytology meetings around the country. She is a technical author for Media Lab, publishing a variety of technical courses and sharing best practices in histology.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
Related Content
Die Inhalte des Knowledge Pathway von Leica Biosystems unterliegen den Nutzungsbedingungen der Website von Leica Biosystems, die hier eingesehen werden können: Rechtlicher Hinweis. Der Inhalt, einschließlich der Webinare, Schulungspräsentationen und ähnlicher Materialien, soll allgemeine Informationen zu bestimmten Themen liefern, die für medizinische Fachkräfte von Interesse sind. Er soll explizit nicht der medizinischen, behördlichen oder rechtlichen Beratung dienen und kann diese auch nicht ersetzen. Die Ansichten und Meinungen, die in Inhalten Dritter zum Ausdruck gebracht werden, spiegeln die persönlichen Auffassungen der Sprecher/Autoren wider und decken sich nicht notwendigerweise mit denen von Leica Biosystems, seinen Mitarbeitern oder Vertretern. Jegliche in den Inhalten enthaltene Links, die auf Quellen oder Inhalte Dritter verweisen, werden lediglich aus Gründen Ihrer Annehmlichkeit zur Verfügung gestellt.
Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.



