
Spezialfärbungen – Welche, warum und wie? Teil 2: Bindegewebe

„Spezialfärbung“ ist ein Begriff,der sich auf verschiedene alternative Färbetechniken bezieht, die verwendet werden, wenn die traditionelle H&E nicht alle Informationen liefert, die der Pathologe oder Forscher von einem Gewebeobjektträger benötigt. Spezialfärbungen sind Methoden zum Nachweis von Gewebebestandteilen, die auf der Affinität bestimmter Farbstoffe oder anderer Substanzen zu eben jenen Gewebekomponenten aufbauen. Sie ermöglichen es, die An- oder Abwesenheit bestimmter Zelltypen, Strukturen und/oder Mikroorganismen mikroskopisch darzustellen. Spezialfärbungen existierten lange vor der Immunhistochemie (IHC) und molekularen Techniken, die mit Sonden arbeiten. Es handelt sich also um verschiedene Methoden.
Einleitung – Bindegewebe
Das Bindegewebe besteht aus Zellen, die in eine Matrix eingebettet sind. Gemeinsam erfüllen Zellen und Matrix verschiedene Funktionen, geben dem Körper seine Form und verbinden verschiedenste Strukturen. In der genannten Matrix finden sich drei Haupttypen von Fasern:
Kollagenfasern bestehen aus Kollagenmolekülen und machen Bänder und Sehnen zugfest. Außerdem sind Kollagenfasern für die Elastizität der Haut verantwortlich. Sie lassen sich am besten mit einer H&E-Färbung sichtbar machen.
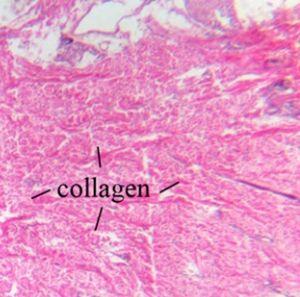
Elastische Fasern finden sich unter anderem in der Haut und den Wänden der großen Arterien. Sie bestehen aus Elastin und verleihen den genannten Geweben die Fähigkeit, nach Kontraktion oder passiver Dehnung ihre gewöhnliche Form wieder aufzunehmen. In der H&E-Färbung stellen sich elastische Fasern nicht dar.
Retikuläre Fasern enthalten Kollagen III und entsprechen somit einem Subtyp der Kollagenfasern. Sie bilden stützende Fasernetze um periphere Nervenfasern, Skelettmuskelfasern und Fettzellen und kommen außerdem in den lymphatischen Organen vor. Auch sie lassen sich in der H&E-Färbung nicht erkennen.
Die am häufigsten verwendeten Färbungen zur Darstellung von Bindegewebe
Masson-Trichrom-Färbung
Für diese Färbung werden drei Farbstoffe genutzt, die Gewebebestandteile selektiv anfärben, einschließlich Kollagenfasern (blau), Muskulatur und Erythrozyten (beide rot) sowie Zellkerne (schwarz).
In der Praxis wird sie genutzt, um Leberbiopsien zu färben und den Fortschritt einer eventuellen Zirrhose zu bestimmen. In Nierenbiopsien ermöglicht sie eine gute Beurteilung der Basalmembran sowie den Nachweis von Immunkomplexablagerungen. Weiterhin dient die Masson-Trichrom-Färbung der Differenzierung von glatter Muskulatur und Kollagen in Tumoren.
Die Methode
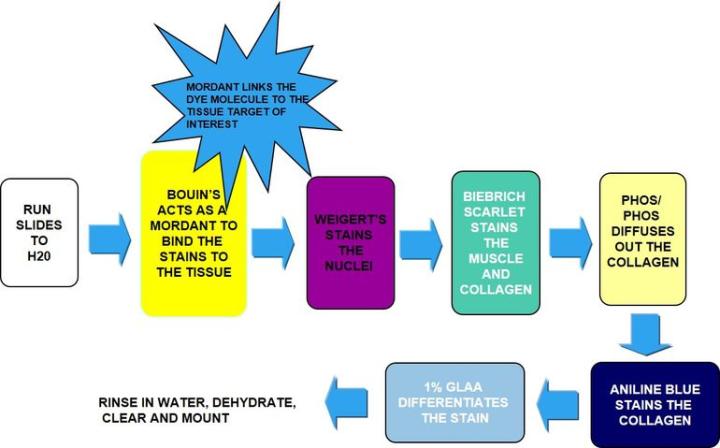
Die Ergebnisse
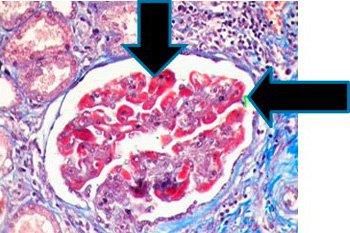
Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren.
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Inkubation in Bouin'scher Lösung, die als Beizmittel wirkt und die Bindung des Farbstoffs an das Gewebe stärkt |
|
|
meist über Nacht |
|
|
10-15 Min. |
|
|
3. |
Unter fließendem Wasser gründlich abspülen, um sämtliche Reste Bouin'scher Lösung zu entfernen |
|
|
4. |
Hämatoxylin nach Weigert |
5-10 Min. |
|
5. |
Unter fließendem Wasser abspülen |
5 Min. |
|
6. |
Biebricher Scharlach |
15 Min. |
|
7. |
Unter fließendem Wasser abspülen |
|
|
8. |
Wolframato-/Molybdatophosphorsäure-Lösung |
15 Min. |
|
9. |
Direkt in Analinblau überführen, ohne zu waschen |
5 Min. |
|
10. |
Direkt in Eisessig 1 % überführen |
1-3 Min. |
|
11. |
Unter fließendem Wasser abspülen |
|
|
12. |
Entwässern, klären, eindecken |
Fehlerbehebung bei der Masson-Trichrom-Färbung:
Es ist ausschlaggebend, Bouin'sche Lösung guter Qualität zu verwenden und sowohl Temperatur- als auch Zeitvorgaben einzuhalten. Differenzieren Sie Kollagen mit Wolframato-/Molybdatophosphorsäure, bis alles Rot beseitigt ist. Bei allzu blasser Muskelfärbung ist die Qualität der Bouin‘schen Lösung und des Biebricher Scharlachs zu überprüfen. Stellen sich die Kollagenfasern zu blass dar, reduzieren Sie die Inkubationszeit im Eisessig.
Einschritt-Trichrom nach Gömöri
Eine Lösung färbt alles: Kollagenfasern, Muskulatur, Erythrozyten und Fibrin. Es stehen zwei Formulierungen zur Verfügung, eine blaue und eine grüne. Damit bezieht man sich auf die Farbe, in der Kollagen dargestellt wird. Bei Verwendung der blauen Lösung werden Kollagenfasern blau angefärbt, ähnlich wie bei der Masson-Trichrom-Färbung. Setzt man die grüne Lösung ein, zeigt sich Kollagen grün, während die übrigen Farbtöne denen der Masson-Trichrom-Färbung entsprechen.
Die Methode

Die Ergebnisse


Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren.
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Inkubation in Bouin'scher Lösung, die als Beizmittel wirkt und die Bindung des Farbstoffs an das Gewebe stärkt |
|
|
meist über Nacht |
|
Hinweis: Wenn die Bouin'sche Lösung in der Mikrowelle erhitzt werden soll, tun Sie das, nehmen Sie sie dann aus der Mikrowelle und geben Sie Ihre Objektträger erst dann in die Lösung. Dazu eignen sich Färbetröge nach Coplin, die vor der Inkubation zu verschließen sind. Erhitzen Sie die Bouin'sche Lösung nicht mit den Präparaten in der Mikrowelle! |
10-15 mins |
|
|
3. |
Unter fließendem Wasser gründlich abspülen, um sämtliche Reste Bouin'scher Lösung zu entfernen |
|
|
4. |
Hämatoxylin nach Weigert |
5-10 Min. |
|
5. |
Unter fließendem Wasser abspülen |
5 Min. |
|
6. |
Einschritt-Lösung, blau oder grün |
15 Min. |
|
7. |
Direkt in Eisessig 1 % überführen |
1 Min |
|
8. |
Unter fließendem Wasser abspülen |
|
|
9. |
Entwässern, klären, eindecken |
Verhöff-van-Gieson-Färbung elastischer Fasern
Mithilfe der Verhöff-van-Gieson-Färbung elastischer Fasern lässt sich beispielsweise eine Atrophie des elastischen Gewebes feststellen, wie sie im Zusammenhang mit Emphysemen auftritt, aber sie liefert auch Hinweise auf Gefäßerkrankungen wie Arteriosklerose und die Gefäßinvasion durch Tumore.
Die Methode
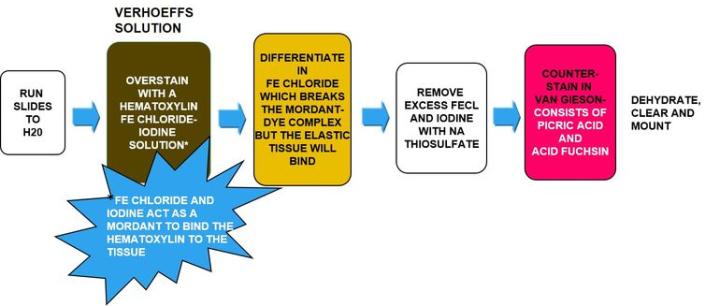
Die Ergebnisse

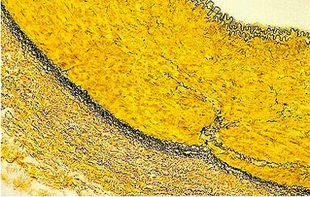
Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren.
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Verhöff-Färbelösung, Arbeitslösung gemäß Herstellerangaben |
15 min |
|
3. |
Unter fließendem Wasser gründlich abspülen |
|
|
4. |
Differenzierung in Eisen(III)chlorid 2 % |
1-2 Min. |
|
5. |
Unter fließendem Wasser abspülen |
5-10 Min. |
|
6. |
Natriumthiosulfat 5 % |
1 Min. |
|
7. |
Unter fließendem Wasser abspülen |
|
|
8. |
Gegenfärbung in van-Gieson-Lösung |
30 Sek. - 1 Min. |
|
9. |
Zur Entwässerung 2× absoluter Ethanol (Ethanol 95 % überspringen) |
|
|
10. |
Klären und eindecken |
Fehlerbehebung bei der Verhöff-van-Gieson-Färbung elastischer Fasern:
Verhöff-Färbelösung sollte unmittelbar vor Gebrauch angesetzt werden, da sie sehr schnell oxidiert. Im Eisen(III)chlorid darf nicht überdifferenziert werden. Eisen(III)chlorid schwächt die Bindung der Farbstoffmoleküle an die Gewebebestandteile, an die sie bis zu diesem Punkt gebunden sind. Belässt man das Präparat zu lange in der Differenzierungslösung, wird zu viel Farbstoff gelöst und man muss von vorn beginnen. Es empfiehlt sich, die Objektträger nach kurzer Inkubation abzuspülen und unter dem Mikroskop nach den elastischen Fasern zu schauen. Wenn sie schwarz gefärbt und problemlos von Kollagen und anderen Gewebeelementen zu unterscheiden sind, sind sie ausreichend differenziert.
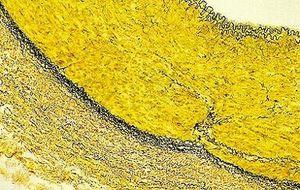
Auch die Inkubationszeit in van-Gieson-Lösung sollte nicht überschritten werden, da sie Pikrinsäure enthält, die das gebundene Hämatoxylin weiter ausdifferenziert.
Retikulinfärbung nach Gömöri
Retikulinfasern erfüllen eine Stützfunktion und finden sich beispielsweise in Leber, Milz, Niere und Knochenmark. Charakteristische Retikulinmuster können bei der Diagnose von Leberzirrhose, früher Myelofibrose und verschiedener Tumore helfen. In letztere Gruppe fallen unter anderem Hämangiosarkome, die vom Endothel der Blutgefäße ausgehen, sowie Rhabdomyosarkome der quergestreiften Muskulatur und fibroblastische Tumoren. Auch die Differenzierung epithelialer und nicht epithelialer Neoplasien beruht zum Teil auf den Retikulinfasern.
Retikulinfärbungen verwenden Silber und beruhen auf den argyrophilen Eigenschaften der Fasern. Argyrophile Zellen sind in der Lage, Silberionen zu binden, können sie aber nicht reduzieren. Dabei sei auf den Unterschied zwischen Adsorption (oberflächliche Bindung) und Absorption (Aufnahme durch die Membran) hingewiesen. Nach der Adsorption der Silberionen durch argyrophile Zellen muss diesen ein Entwickler angeboten werden, der die nicht erkennbaren Silberionen zu sichtbarem metallischen Silber reduziert.
Die Methode
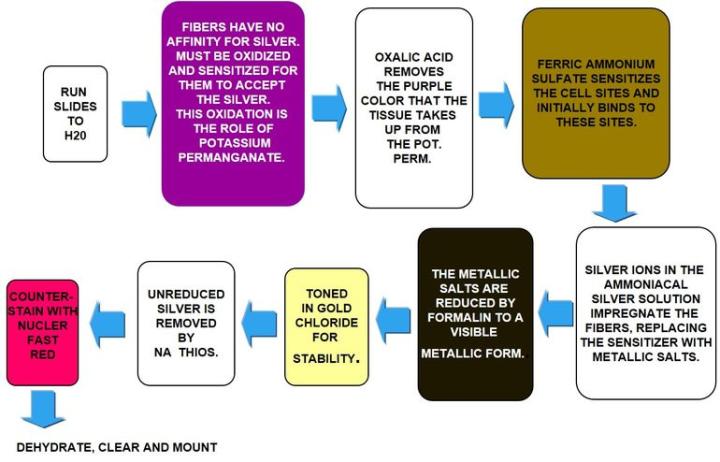
Die Ergebnisse
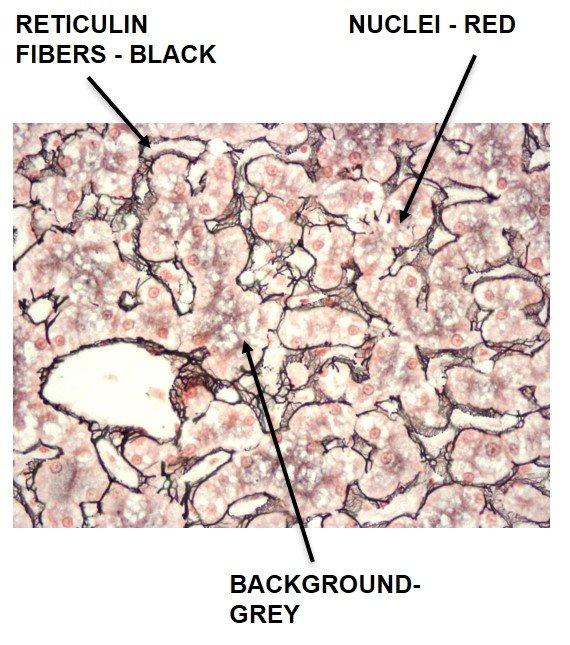
Das Protokoll
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Oxidation in Kaliumpermanganat |
10 Min. |
|
3. |
Unter fließendem Wasser gründlich abspülen |
3 Min. |
|
4. |
Oxalsäure |
1 Min. |
|
5. |
Unter fließendem Wasser gründlich abspülen |
2 Min. |
|
6. |
Sensibilisierung mit Ammoniumeisen(III)sulfat |
15 Min. |
|
7. |
Mit destilliertem Wasser abspülen |
2 Min. |
|
8. |
Imprägnation mit ammoniakalischer Silberlösung |
2 Min. |
|
9. |
Mit destilliertem Wasser abspülen |
1 Min. |
|
10. |
Entwicklung in ungepuffertem Formalin 20 % |
1 Min. |
|
11. |
Unter fließendem Wasser gründlich abspülen |
2 Min. |
|
12. |
Tönung in Goldchlorid 0,1 % |
3-5 Min. |
|
13. |
Mit Wasser abspülen |
1 Min. |
|
14. |
Natriumthiosulfat 5 % |
1 Min. |
|
15. |
Mit Wasser abspülen |
1 Min. |
|
16. |
Gegenfärbung mit Kernechtrot |
3-5 Min. |
|
17. |
Kurz mit Wasser abspülen |
15 Sek |
|
18. |
Entwässern, klären, eindecken |
Fehlerbehebung bei der Retikulinfärbung nach Gömöri:
Die ammoniakalische Silberlösung sollte in sauberer Glasware und mit destilliertem Wasser frisch angesetzt werden. Achten Sie auch auf die Qualität der Reagenzien. Wird altes Ammoniumhydroxid mit vermindertem Ammoniakgehalt verwendet, kann sich das nachteilig auf das Färbeergebnis auswirken. Verwenden Sie nicht zu viel Ammoniumhydroxid, um die Lösung aus Silbernitrat und Natriumhydroxid zu klären. Überschüssiges Ammoniumhydroxid führt zu einer schwachen Färbung.
Wie ammoniakalische Silberlösung herzustellen ist:

Wie sich Kollagen, elastische und retikuläre Fasern, Zellkerne und Muskulatur in einem einzigen Verfahren darstellen lassen
Movat Pentachrome
Movat Pentachrome ist eine gute Bindegewebsfärbung. Es wird verwendet, um Herzgewebe, Blutgefäße sowie Gefäß- und Lungenerkrankungen zu untersuchen. Aufgrund der hervorragenden Differenzierung von Kollagen-, Elastik-, Fibrin- und Muskelfasern kann der Movat Pentachrome subtile Veränderungen zeigen, die Routinefärbungen und Spezialfärbungen nicht zeigen.
Die Methode
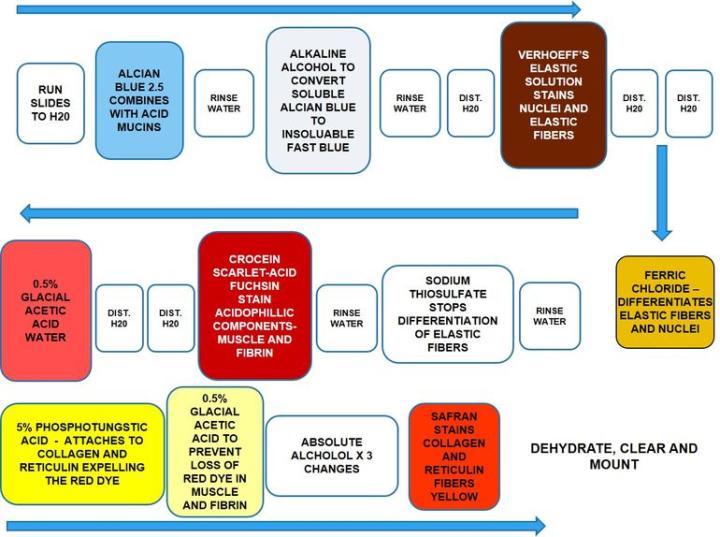
Die Ergebnisse

Das Protokoll
Die Inkubationszeiten und die Reihenfolge der Reagenzien können in Abhängigkeit vom Hersteller variieren, aber die unterschiedlichen Protokolle liefern ähnliche Ergebnisse.
|
1. |
Objektträger in Wasser eintauchen |
|
|
|
2. |
Alcianblau |
20 Min. |
|
|
3. |
Unter fließendem Wasser gründlich abspülen |
5 Min. |
|
|
4. |
Alkalischer Alkohol |
60 Min. |
|
|
5. |
Unter fließendem Wasser gründlich abspülen |
10 Min. |
|
|
6. |
Mit destilliertem Wasser abspülen |
|
|
|
7. |
Verhöff-Färbelösung |
12-15 Min. |
|
|
8. |
Destilliertes Wasser, 2× |
|
|
|
9. |
Eisen(III)chlorid |
|
|
|
10. |
Mit destilliertem Wasser abspülen |
|
|
|
11. |
Natriumthiosulfat |
1 Min. |
|
|
12. |
Unter fließendem Wasser gründlich abspülen |
5 Min. |
|
|
13. |
Biebricher Scharlach und saures Fuchsin |
90 Sek. - 3 Min. |
|
|
14. |
Destilliertes Wasser, 2× |
|
|
|
15. |
Essigsäure 0,5 % |
|
|
|
16. |
Wässrige Wolframatophosphorsäure 5 %, 2× |
je 5 Min. |
|
|
17. |
Essigsäure 0,5 % |
|
|
|
18. |
Ethanol absolut, 3× |
kurz eintauchen |
|
|
19. |
Safran |
15 Min. |
|
|
20. |
Ethanol absolut, 2× |
|
|
|
21. |
Klären und eindecken |
|
Fehlerbehebung bei der Movat-Pentachromfärbung
Alcianblau sollte bei einem pH-Wert von 2,5 verwendet werden. Die vollständige Entfernung des alkalischen Alkohols ist unerlässlich für ein gutes Färbeergebnis. Verhöff-Färbelösung sollte unmittelbar vor Gebrauch angesetzt werden, da sie sehr schnell oxidiert. Eine Überdifferenzierung der elastischen Fasern in Eisen(III)chlorid ist zu vermeiden. Tauchen Sie die Objektträger ein- oder zweimal in die Differenzierungslösung ein, spülen Sie sie dann in destilliertem Wasser ab und schauen Sie die Präparate unter dem Mikroskop an. Bei Bedarf kann dieser Schritt wiederholt werden. Verwenden Sie zur Entwässerung keine aufsteigende Alkoholreihe. Beginnen Sie direkt in absolutem Ethanol. Die Schnitte dürfen während des Färbens nicht austrocknen.
About the presenter

Carolyn Doan received her ASCP registration in 1969 after completing classes at Georgia State University and St Joseph school of Histotechnology in Atlanta, Georgia. For 40 years she shared her passion for histology in research (at Yerkes Primate Research Center), in the clinical world (managing the Pathology Department at Florida Hospital in Orlando and serving on the board of the Florida State Licensure Task Force and as president of the Florida State Society for Histotechnology), and in industry (as a Sales executive, Marketing Manager and North American staining sales specialist). Since her retirement in 2013, she founded Creative Histology Consulting.
Referenzen
- Rolls G. 101 Schritte zu einer besseren Histologie – Ein praktischer Leitfaden zur guten histologischen Praxis. Leica Biosystems Knowledge Pathway.
- Shaikh I. Special Stains in Histopathology. Kem Hospital, 2012.
- Sheehan D, Hrapchak B. Theory And Practice Of Histotechnology. 2nd ed. Ohio: Battelle Press, 1987.
- Culling CFA, Allison RT and Barr WT eds. Cellular Pathology Technique. 4th ed. London: Butterworths, 1985.
- Wikipedia. Ammoniacal Silver. Nov, 2013.
- Russel HK. A Modification of the Movat Pentachrome Stain. Bogen Pathol, 1972; 94;187.
Die Inhalte des Knowledge Pathway von Leica Biosystems unterliegen den Nutzungsbedingungen der Website von Leica Biosystems, die hier eingesehen werden können: Rechtlicher Hinweis. Der Inhalt, einschließlich der Webinare, Schulungspräsentationen und ähnlicher Materialien, soll allgemeine Informationen zu bestimmten Themen liefern, die für medizinische Fachkräfte von Interesse sind. Er soll explizit nicht der medizinischen, behördlichen oder rechtlichen Beratung dienen und kann diese auch nicht ersetzen. Die Ansichten und Meinungen, die in Inhalten Dritter zum Ausdruck gebracht werden, spiegeln die persönlichen Auffassungen der Sprecher/Autoren wider und decken sich nicht notwendigerweise mit denen von Leica Biosystems, seinen Mitarbeitern oder Vertretern. Jegliche in den Inhalten enthaltene Links, die auf Quellen oder Inhalte Dritter verweisen, werden lediglich aus Gründen Ihrer Annehmlichkeit zur Verfügung gestellt.
Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.