
Spezialfärbungen – Welche, warum und wie? Teil 3: Bakterien, Pilze und andere Mikroorganismen

Mikroorganismen sind lebende Organismen, zu denen unter anderem Bakterien und Pilze, aber Protozoen und Viren zählen. Sie sind so klein, dass sie nur mithilfe eines Mikroskops betrachtet werden können, und für die kleinsten unter ihnen bedarf es eines Elektronenmikroskops. Bakterien, Pilze und Protozoen lassen sich mit histochemischen Verfahren darstellen und identifizieren, während in der Virologie eher immunhistochemische Methoden zur Anwendung kommen.
Einleitung – Bakterien
Bakterien sind einzellige Organismen, die nur wenige Mikromillimeter groß und deshalb vom menschlichen Auge nicht erkennbar sind. Als Beispiele seien drei Bakterien genannt, die beim Menschen häufig vorkommen, nämlich Mycobacterium tuberculosis, Mycobacterium leprae und Helicobacter pylori.
MYCOBACTERIUM TUBERCULOSIS
Mycobacterium tuberculosis ist der für den Menschen wichtigste Tuberkuloseerreger. Es handelt sich um ein Stäbchenbakterium, das nicht aktiv beweglich ist und sich zudem durch die Eigenschaft der „Säurefestigkeit“ auszeichnet. Das bedeutet, dass sich der Farbstoff, der zum Färben dieser Bakterien verwendet wird, durch eine Inkubation in saurer Lösung nicht entfernen lässt. Der Nachweis säurefester Stäbchen erfolgt über entsprechende Färbungen, die aufgrund der englischen Bezeichnung „acid-fast bacilli“ auch AFB-Färbungen genannt werden.
Für die Säurefestigkeit des Erregers ist die Mykolsäure verantwortlich. Diese wachsartige Substanz findet sich in der Zellwand von M. tuberculosis. Auf der einen Seite erschwert die Mykolsäure das Eindringen des Farbstoffs in die Zelle, was methodisch berücksichtigt werden muss, aber vor allem verhindert sie die anschließende Entfärbung in Salzsäure-Alkohol. Die gebräuchlichsten AFB-Färbungen sind die Ziehl-Neelsen-Färbung und die Kinyoun-Färbung. Beide Methoden sind sich hinsichtlich Grundlagen, Protokollen und Ergebnissen sehr ähnlich.
Kinyoun-Färbung mit Karbolfuchsin
Die Methode

Die Ergebnisse
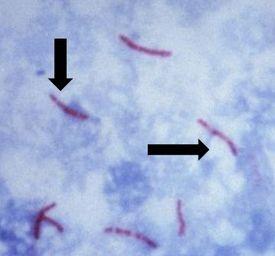
Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren.
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Karbolfuchsin bei Raumtemperatur |
30 to 60 Min. |
|
3. |
Bei Erwärmung auf 60 °C sind kürzere Inkubationszeiten möglich |
|
|
4. |
Unter fließendem Wasser gründlich abspülen |
5 Min. |
|
5. |
Salzsäure-Alkohol (1 % / 70 %) |
10 Sek. |
|
6. |
Unter fließendem Wasser gründlich abspülen |
2 Min. |
|
7. |
Methylenblau bis zur gewünschten Farbintensität |
30-40 Sek. |
|
8. |
Kurz unter fließendem Wasser abspülen |
15 Sek. |
|
9. |
Sofort in Alkohol entwässern |
|
|
10. |
Klären, eindecken |
Fehlerbehebung bei der Färbung säurefester Bakterien
Es ist sehr wichtig, überschüssiges Karbolfuchsin durch gründliches Waschen zu entfernen. Stellen Sie sicher, dass der gesamte Objektträger von Wasser bedeckt ist und keine Bereiche ungewaschen bleiben. Farbstoffreste können sich ihren Weg durch das Gewebe bahnen und sich nachteilig auf das Färbeergebnis auswirken. Die Entfärbung geht schnell. Inkubieren Sie Ihr Präparat in Salzsäure-Alkohol, bis der Objektträger sauber erscheint und das Gewebe eine leichte Rosafärbung zeigt. Nach der Entfärbung wird die Probe erneut gründlich gewaschen. Es ist wichtig, dass keine Rückstände von Salzsäure-Alkohol auf dem Objektträger verbleiben. Was Methylenblau betrifft, so ist weniger mehr. Wenn mit Methylenblau überfärbt wird, kann diese Gegenfärbung die säurefesten Bakterien überdecken. Der Grat zwischen zu viel Methylenblau und zu wenig ist schmal. Eine zu starke Färbung erschwert das Auswaschen und maskiert möglicherweise die säurefesten Erreger, um die es in erster Linie geht. Bei zu schwacher Färbung allerdings kann es passieren, dass alles Methylenblau ausgewaschen wird und es dem Präparat an Kontrast mangelt. Ausprobieren und Erfahrung sammeln sind die beste Antwort auf die Frage, wie viel Methylenblau es denn sein soll.
Wie eben erwähnt, kann Methylenblau in Alkoholen schnell ausgewaschen werden. Beginnen Sie die Entwässerung deshalb mit Ethanol 100 % und belassen Sie den Objektträger nur kurze Zeit in diesem und zwei weiteren Alkoholbädern. So stellen sie sicher, dass Sie entwässern, nicht entfärben.
MYCOBACTERIUM LEPRAE
Mycobacterium leprae ist der Erreger der Lepra. Es handelt sich auch hier um ein säurefestes Stäbchen, ähnlich wie bei M. tuberculosis. Der Nachweis dieses Pathogens erfolgt vornehmlich mit der Fite-Faraco-Färbung, einer angepassten Variante der Ziehl-Neelsen-Färbung.
Fite-Faraco-Färbung
Die Methode


Die Ergebnisse

Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren.
|
1. |
Objektträger im Ofen trocknen |
|
|
2. |
In einer 1:1 Mischung aus Xylol und Erdnussöl inkubieren |
15 Min. |
|
3. |
Schritt in frisch angesetzter Xylol-Erdnussöl-Mischung wiederholen |
15 Min. |
|
4. |
Trocken tupfen und wiederholt in Wasser waschen, um Ölreste zu entfernen |
5 Min. |
|
5. |
Karbolfuchsin bei Raumtemperatur |
20 Min. |
|
6. |
Unter fließendem Wasser gründlich abspülen |
|
|
7. |
Salzsäure-Alkohol (1 % / 70 %) |
1-5 Sek. |
|
8. |
Unter fließendem Wasser abspülen |
|
|
9. |
Methylenblau |
10-20 Sek. |
|
10. |
Sofort unter fließendem Wasser abspülen |
|
|
11. |
Trocknen, nicht in Alkohol überführen, klären und eindecken |
Fehlerbehebung bei der Fite-Faraco-Färbung
Wenn die Objektträger versehentlich gemäß einem Standardprotokoll zur Entparaffinierung mit Xylol und Alkoholen behandelt werden, empfiehlt es sich, frische Schnitte zu erstellen und von vorn zu beginnen. Folgen Sie den Empfehlungen zur Kinyoun-Färbung mit Karbolfuchsin, um optimale Ergebnisse zu erzielen.
HELICOBACTER PYLORI
Helicobacter pylori ist ein spiralförmig gewundenes Stäbchenbakterium, dass mit Gastritiden, peptischen Ulzera und Magenkarzinomen in Verbindung gebracht wird. H. pylori ist argyrophil, bindet Silberionen, kann sie aber nicht reduzieren. Zum Nachweis dieses Bakteriums werden die Warthin-Starry-Färbung oder eine der zahlreichen Varianten dieser Silberfärbung eingesetzt, außerdem die Giemsa-Färbung und immunhistochemische Verfahren, wobei letztere die höchste Sensitivität haben.
Warthin-Starry-Färbung
Die Methode

Die Ergebnisse

Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren.
Hinweis: Der Warthin-Starry-Färbung wird zur Darstellung verschiedener Mikroorganismen verwendet und färbt nicht nur H. pylori an. Aus diesem Grund finden Sie möglicherweise Protokolle, die von der Helicobacter-spezifischen Methode abweichen.
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Mit demineralisiertem Wasser abspülen |
|
|
3. |
Silbernitrat 0,5-1 %, auf 65 °C vorgewärmt |
3–5 Min. |
|
4. |
Entwicklerlösung |
1–5 Min. |
- Objektträger in mit Entwicklerlösung gefüllten Färbetrog nach Coplin legen
- Färbetrog in auf 65 °C vorgeheiztes Wasserbad stellen
- Inkubieren, bis das Gewebe eine bräunlich-goldene Farbe annimmt

|
5. |
Mit warmem Wasser abspülen |
2–3 Min. |
|
6. |
In absolutem Ethanol entwässern |
|
|
7. |
Klären, eindecken |
Fehlerbehebung bei der Warthin-Starry-Färbung für H. pylori
Die Warthin-Starry-Färbung ist keine ganz einfache Färbung. Achten Sie darauf, den Anweisungen des Herstellers zum Mischen der Lösungen Folge zu leisten. Verwenden Sie saubere Glaswaren und demineralisiertes Wasser, wo es erforderlich ist. Es ist wichtig, das Wasserbad für die Inkubation mit Silbernitrat und der Entwicklerlösung vorzuheizen. Die Silbernitratlösung sollte eine Temperatur von 65 °C erreicht haben, bevor die Objektträger eingetaucht werden. Während sich die Entwicklerlösung erwärmt, nimmt das Gewebe allmählich eine goldbraune Farbe an, die charakteristisch für die Reduktion der Silberionen ist und anzeigt, dass der Schritt nahezu abgeschlossen ist. Ein sanftes Schwenken der Präparate in der Entwicklerlösung trägt zu einer gleichmäßigeren Färbung bei.
Hinweis: Statt des Wasserbads kann eine Mikrowelle zur Erwärmung verwendet werden. Die Zeiten sind dann aber anzupassen.
Giemsa-Färbung
Die Giemsa-Färbung ist eine polychromatische Färbung, bei der Farbstoffe mit verschiedenen Farbtönen zum Einsatz kommen.
Die Methode

Die Ergebnisse

Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren.
|
1. |
Fixierung in Methanol 95 % |
|
|
2. |
Jenner-Arbeitslösung |
10 Min. |
|
3. |
Giemsa-Arbeitslösung |
45 Min. |
|
4. |
Eisessig 1 % |
10 Sek. |
|
5. |
Sofort unter fließendem Wasser abspülen |
|
|
6. |
Gut abtupfen, klären und eindecken |
Fehlerbehebung bei der Giemsa-Färbung für H. pylori
Jenner- und Giemsa-Lösungen sind beide sehr instabil und sollten vor dem Gebrauch frisch angesetzt werden. Filtern Sie die Lösungen, bevor Sie sie verwenden. Die Inkubation in Eisessig ist kurz, aber essenziell für das Färbeergebnis. Eine zu kurze Inkubation resultiert in einer geringen Differenzierbarkeit der Zellen. Eine zu lange Inkubation hingegen reduziert die Färbeintensität erheblich. Tupfen Sie das Präparat ab, anstatt es in der Alkoholreihe zu entwässern, um zu vermeiden, dass die Blaufärbung ausgewaschen wird.
Nachstehend ein Vergleich der beiden Färbungen und einer Immunhistochemie zur Darstellung von H. pylori.



Einleitung – Pilze
Das Reich der Pilze umfasst sowohl einzellige als auch mehrzellige Organismen, die sich bezüglich ihrer Nuklei und Zellwände unterscheiden. Drei bekanntermaßen humanpathogene Pilze sind Cryptococcus neoformans, Histoplasma capsulatum und Pneumocystis jirovecii.
CRYPTOCOCCUS NEOFORMANS
Cryptococcus neoformans kommt weltweit in der Umwelt vor und kann beim Menschen eine Meningitis auslösen. Infektionen betreffen meist immungeschwächte Personen. Die Kapseln von C. neoformans lassen sich mithilfe der Muzikarminfärbung aber auch im Rahmen der Grocott-Methamin-Silberfärbung gut anfärben.
Muzikarmin
Die Methode

Die Ergebnisse

Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren.
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Hämatoxylin nach Weigert |
5–10 Min. |
|
3. |
Unter fließendem Wasser abspülen |
|
|
4. |
Muzikarmin |
20–30 Min. |
|
5. |
Unter fließendem Wasser abspülen |
|
|
6. |
Metanilgelb |
1–3 Min. |
|
7. |
Kurz unter fließendem Wasser abspülen |
|
|
8. |
Entwässern, klären, eindecken |
Fehlerbehebung bei der Muzikarminfärbung
Befolgen Sie beim Ansetzen der Muzikarminlösung die Anweisungen des Herstellers. Verwenden Sie nur geeignetes Wasser und richten Sie sich auch bezüglich der Verdünnung nach den Herstellerempfehlungen. Das Hämatoxylin nach Weigert sollte frisch angesetzt sein. Wenn es nicht mehr violett, sondern bräunlich erscheint, hat es sich zersetzt und wird keine zufriedenstellende Kernfärbung liefern. Einmal angesetztes Hämatoxylin nach Weigert sollte im Laufe desselben Tages verwendet werden, am Folgetag aber nicht mehr.
HISTOPLASMA CAPSULATUM
Histoplasma capsulatum ist der Erreger der Histoplasmose. Zur Infektion mit grippeähnlichen Symptomen kommt es nach Einatmung der Sporen des Pilzes. Bleibt die Histoplasmose unbehandelt, kann sich eine disseminierte Infektion entwickeln und zum Tode führen. Derart schwere Verläufe treten häufiger bei immungeschwächten Patienten auf. H. capsulatum lässt sich in der Grocott-Methenamin-Silberfärbung nachweisen.
PNEUMOCYSTIS JIROVECII
Pneumocystis jirovecii ist ebenfalls ein opportunistischer Erreger. Hat man ihn früher den Protozoen zugeordnet, so gilt er nach Nukleinsäure- und biochemischen Analysen inzwischen als Pilz. Bei immunsupprimierten Patienten kann dieses Pathogen schwerste Lungenentzündungen mit hoher Mortalität auslösen. Auch P. jirovecii lässt sich in der Grocott-Methenamin-Silberfärbung darstellen.
Grocott-Methenamin-Silberfärbung
Die Grocott-Methenamin-Silberfärbung macht sich die Argentaffinität bestimmter Zelltypen zunutze. Von diesen Zellen werden nicht erkennbare Silberionen ohne äußeres Zutun zu sichtbarem metallischem Silber reduziert; im Gegensatz dazu muss zur Darstellung argyrophiler Organismen, wie H. pylori, ein Reduktionsmittel angeboten werden.
Die Methode
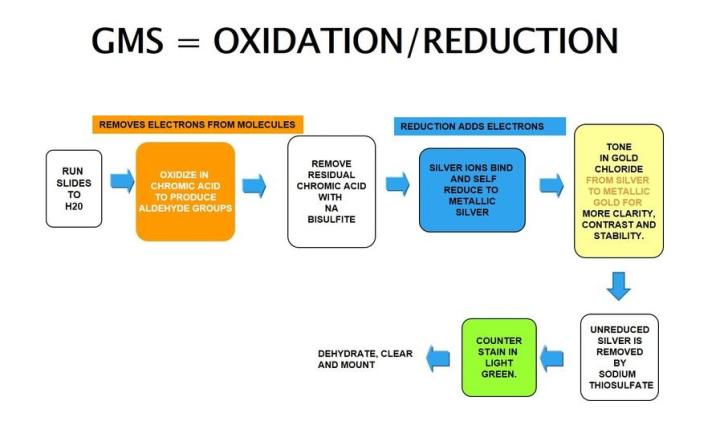
Die Ergebnisse



Das Protokoll
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Chromsäure zur Oxidation |
10 Min. |
|
3. |
Unter fließendem Wasser gründlich abspülen |
3 Min. |
|
4. |
Natriumbisulfit |
1 Min. |
|
5. |
Unter fließendem Wasser abspülen |
|
|
6. |
Unter fließendem Wasser abspülen |
10 – 20 Min. |
|
7. |
Inkubationszeit ist abhängig von der Geschwindigkeit der Imprägnierung |
|
|
8. |
Mit demineralisiertem Wasser abspülen |
|
|
9. |
Goldchlorid |
1 – 2 Min. |
|
10. |
Unter fließendem Wasser abspülen |
|
|
11. |
Natriumthiosulfat |
1 Min. |
|
12. |
Unter fließendem Wasser abspülen |
|
|
13. |
Gegenfärbung mit Lichtgrün |
30 - 40 Sek. |
|
14. |
Sofort unter fließendem Wasser abspülen |
|
|
15. |
Entwässern, klären, eindecken |
Fehlerbehebung bei der GMS-Färbung
Die Chromsäurelösung sollte häufig gewechselt werden, um einem Verbrauch vorzubeugen und eine vollständige Oxidation zu ermöglichen. Geeignete Zeitintervalle hängen auch von der Anzahl der Objektträger ab, die verarbeitet werden. Halten Sie das entsprechende Gefäß geschlossen, wenn es nicht in Gebrauch ist. Bei manueller Ausführung des Protokolls bedarf es ein wenig Geduld, um das notwendige Fingerspitzengefühl für die Imprägnierzeiten zu entwickeln, die unter anderem mit der verwendeten Heizmethode variieren und sich zwischen Wasserbad und Mikrowelle unterscheiden. Die Gegenfärbung mit Lichtgrün sollte nicht zu intensiv sein, da sonst die gesuchten Mikroorganismen maskiert werden könnten.
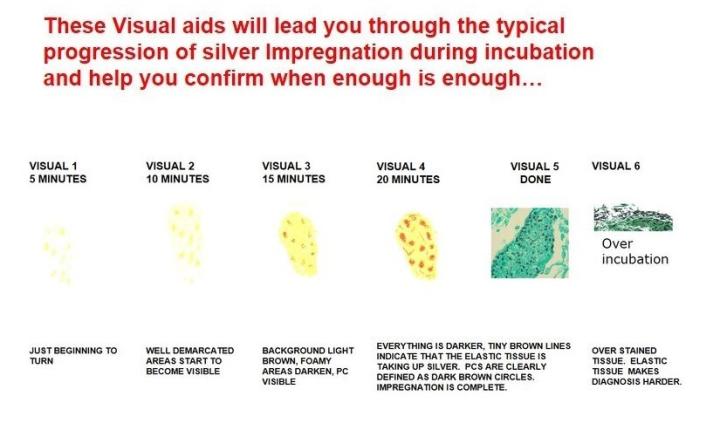
GMS-Färbung für Pneumocystis
About the presenter

Carolyn Doan received her ASCP registration in 1969 after completing classes at Georgia State University and St Joseph school of Histotechnology in Atlanta, Georgia. For 40 years she shared her passion for histology in research (at Yerkes Primate Research Center), in the clinical world (managing the Pathology Department at Florida Hospital in Orlando and serving on the board of the Florida State Licensure Task Force and as president of the Florida State Society for Histotechnology), and in industry (as a Sales executive, Marketing Manager and North American staining sales specialist). Since her retirement in 2013, she founded Creative Histology Consulting.
Referenzen
- Rolls G. 101 Schritte zu einer besseren Histologie – Ein praktischer Leitfaden zur guten histologischen Praxis. Leica Biosystems Knowledge Pathway.
- Shaikh I. Special Stains in Histopathology. Kem Hospital, 2012.
- Ellis R. IMVS Division of Pathology, The Queen Elizabeth Hospital, Woodville, South Australia.
- Wikipedia – Pneumocystis jirovecii
- Kerr DA. Improved Warthin Starry Method for Tissue Sections. Am J Clin Pathol, 1938; 8;63-67.
- Bain B, Bates I, Laffan M. Dacie und Lewis Practical Hematology. 12th ed. Philadelphia: Elsevier, 2017.
- Stringer JR. The identity of Pneumocystis carinii: not a single protozoan, but a diverse group of exotic fungi. Infect Agents Dis, 1993;2;109-17.
- Sheehan D, Hrapchak B. Theory And Practice Of Histotechnology. 2nd ed. Ohio: Battelle Press, 1987.
- Ackerman AB. Derm101.com, 2000.
Die Inhalte des Knowledge Pathway von Leica Biosystems unterliegen den Nutzungsbedingungen der Website von Leica Biosystems, die hier eingesehen werden können: Rechtlicher Hinweis. Der Inhalt, einschließlich der Webinare, Schulungspräsentationen und ähnlicher Materialien, soll allgemeine Informationen zu bestimmten Themen liefern, die für medizinische Fachkräfte von Interesse sind. Er soll explizit nicht der medizinischen, behördlichen oder rechtlichen Beratung dienen und kann diese auch nicht ersetzen. Die Ansichten und Meinungen, die in Inhalten Dritter zum Ausdruck gebracht werden, spiegeln die persönlichen Auffassungen der Sprecher/Autoren wider und decken sich nicht notwendigerweise mit denen von Leica Biosystems, seinen Mitarbeitern oder Vertretern. Jegliche in den Inhalten enthaltene Links, die auf Quellen oder Inhalte Dritter verweisen, werden lediglich aus Gründen Ihrer Annehmlichkeit zur Verfügung gestellt.
Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.