
Spezialfärbungen – Welche, warum und wie? Teil 1: Muzine und Glykogen

„Spezialfärbung“ definieren
Spezialfärbung ist ein Begriff, der sich auf verschiedene alternative Färbetechniken bezieht, die verwendet werden, wenn die traditionelle H&E nicht alle Informationen liefert, die der Pathologe oder Forscher von einem Gewebeobjektträger benötigt. „Spezialfärbungen“ sind Methoden zum Nachweis von Gewebebestandteilen, die auf der Affinität bestimmter Farbstoffe oder anderer Substanzen zu eben jenen Gewebekomponenten aufbauen. Sie ermöglichen es, die An- oder Abwesenheit bestimmter Zelltypen, Strukturen und/oder Mikroorganismen mikroskopisch darzustellen. Spezialfärbungen existierten lange vor der Immunhistochemie (IHC) und molekularen Techniken, die mit Sonden arbeiten. Es handelt sich also um verschiedene Methoden.
Muzine – Eine kurze Einleitung
Muzine gehören zur großen und komplexen Gruppe der Kohlenhydrate. Die Kohlenhydrate lassen sich grob in Zucker und Stärken unterscheiden. Eine etwas genauere, wenn auch immer noch recht grobe Einteilung berücksichtigt Monosaccharide, Polysaccharide und Mukopolysaccharide als Arten von Kohlenhydraten. Muzine wiederum sind Mukopolysaccharide, die als Proteine verstanden werden können, denen lange Ketten von Zuckermolekülen anhängen. Sie sind im gesamten Körper zu finden und sorgen unter anderem für die strukturelle Integrität von Knochen, Knorpel, Haut, elastischem Bindegewebe und Membranen. Sie sind weiterhin wichtig für das Überleben und Wachstum der Zellen, da sie den Nährstofffluss zwischen Kapillaren und Zellen regulieren.
Im Wesentlichen gibt es zwei Arten von Muzinen:
Saure Muzine tragen negative Ladungen in den Kohlenhydratseitenketten. Eine weitere Unterteilung kann in Abhängigkeit davon erfolgen, ob die negative Ladung auf eine Carboxylgruppe (schwach saure Muzine) oder eine Sulfonatgruppe (stark saure Muzine) zurückzuführen ist. Sie sind im gesamten Gastrointestinaltrakt und den Atemwegen zu finden.
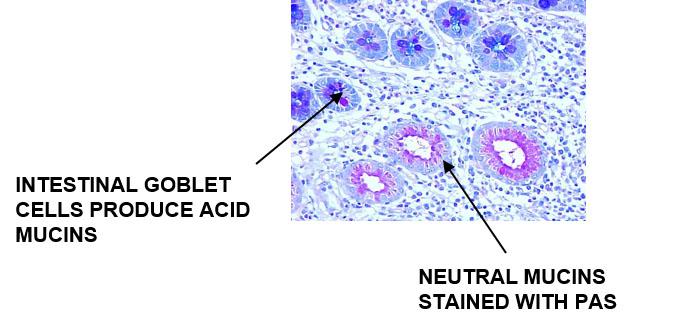
Neutrale Muzine hingegen tragen keine dieser funktionellen Gruppen und bleiben ungeladen. Sie befinden sich in der Magenschleimhaut und in den Brunner-Drüsen des Duodenums, aber auch im Prostataepithel. Sie schützen die Duodenalschleimhaut vor dem stark sauren Magensaft und helfen, ein alkalisches Milieu zu schaffen, in dem die Verdauungsenzyme optimal arbeiten können. Außerdem wirken sie in Darm und Prostata als Gleitmittel.
Saure Muzine – die drei gängigsten Färbungen
1) Alcianblau
Alcianblau ist ein basischer Farbstoff, der Kupfer enthält, was ihm seine blaue Farbe verleiht. Die Farbstoffmoleküle tragen eine positive Ladung und werden von den negativ geladenen Muzinen angezogen. Über eine Anpassung des pH-Werts der Alcianblau-Lösung lassen sich verschiedene Subtypen von Muzinen detektieren.
Bei einem pH-Wert von 2,5 ist eine umfassende Muzinfärbung zu erreichen:
- Anfärbung carboxylierter, schwach saurer Muzine in Bindegewebe und Knorpel
- Becherzellen im Barrett-Ösophagus
Bei einem pH-Wert von 1,0 werden vor allem sulfonierte, stark saure Muzine angefärbt, z. B. in folgenden Geweben:
- Becherzellen des Dickdarms
- Seromuköse Bronchialdrüsen
- Adenokarzinome
Beispiele für Gewebe, in denen eine Alcianblau-Färbung zum Muzinnachweis gemeinhin positive Ergebnisse liefert:
- Becherzellen im Darm
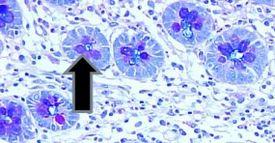
- Becherzellen im Barrett-Ösophagus
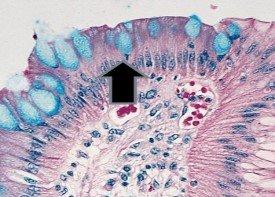
- Mukoide Kapsel von Mikroorganismen, hier Cryptococcus

- Mastzellgranula, die die Identifikation dieser Immunzellen erleichtern

Beispiele für pathologische Prozesse, bei deren Erkennung Alcianblau helfen kann:
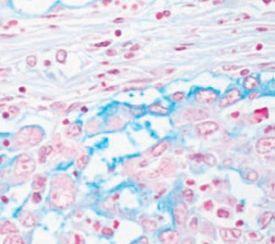
- Muzinöse Tumore
- Karzinome, die aus mindestens 60 % Schleim bestehen, werden als muzinös bezeichnet
- Muzinöse Tumore machen etwa 10-15 % aller Adenokarzinome aus
- Im folgenden Bild ein Adenokarzinom, in dem die Schleimproduktion mit Alcianblau bestätigt wurde
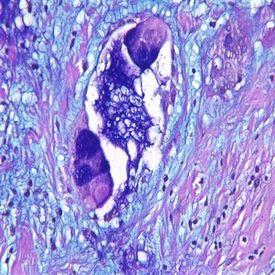
- Myxödem, eine ödematöse Schwellung mit Ablagerung von Muzinen in der Haut und anderen Geweben
- Myxom, ein seltener benigner Herztumor, der bei entsprechendem Wachstum aber den Blutfluss stören kann
|
Gewebeart |
Bestandteile |
Alcianblau bei pH = 2,5 |
Alcianblau bei pH = 1,0 |
|---|---|---|---|
|
Gastrointestinaltrakt |
Neutrale Muzine |
Negativ |
Negativ |
|
Prostata |
Neutrale Muzine |
Negativ |
Negativ |
|
Becherzellen |
Schwach saure Muzine |
Positiv |
Negativ |
|
Stroma |
Schwach saure Muzine |
Positiv |
Negativ |
|
Adenokarzinome |
Stark saure Muzine |
Negativ |
Positiv |
|
Knorpel, Knochen |
Stark saure Muzine |
Negativ |
Positiv bei pH = 0,5 |
Hinweis: Alcianblau färbt keine neutralen Muzine an.
Die Methode

Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Alcianblau (pH-Wert der Lösung beachten!) |
30 Min. |
|
3. |
Unter fließendem Wasser gründlich abspülen |
2 Min. |
|
4. |
Gegenfärbung mit Kernechtrot |
2 Min. |
|
5. |
Kurz unter fließendem Wasser abspülen |
|
|
6. |
Entwässern, klären, eindecken |
Fehlerbehebung bei der Alcianblau-Färbung:
Kernechtrot sollte vor der Verwendung gut gemischt werden, da es dazu neigt, sich abzusetzen, was sich nachteilig auf die Färbung auswirkt. Kontrollieren Sie den pH-Wert der Alcianblau-Lösung, um falsch negativen Ergebnissen vorzubeugen.
2) Kolloidales Eisen
Kolloidales Eisen erlaubt die Visualisierung von sauren Muzinen. Dank seiner hohen Sensitivität lassen sich auch geringste Mengen saurer Muzine darstellen und in diesem Kontext wird es zuweilen als Alternative zur Alcianblau-Färbung genutzt. Von Bedeutung ist die Färbung mit kolloidalem Eisen beispielsweise für die Diagnose von Nierenzellkarzinomen und bestimmten Mesotheliomen. Mesotheliome gehen vom Mesothel aus, also von der Pleura, dem Peritoneum und den serösen Häuten vieler Organe.
Die Methode
Die Methode beruht auf der Anziehung zwischen positiv geladenen Eisenionen (ferrischen Kationen) und negativ geladenen Gruppen in Muzinen. An Muzine gebundene Eisenionen werden dann mit Kaliumferrocyanid/HCl nachgewiesen, wobei sich ein intensiv blauer Niederschlag bildet.


Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Inkubation in Eisessig 12 % |
12 Min. |
|
3. |
Sofort in kolloidale Eisenlösung überführen |
60 Min. |
|
4. |
In Eisessig 12 % spülen |
3 Min. |
|
5. |
Eisessig wechseln, noch einmal spülen |
3 Min. |
|
6. |
Ferrocyanid/HCl-Lösung |
20 Min. |
|
7. |
Unter fließendem Wasser abspülen |
2 Min. |
|
8. |
Gegenfärbung mit Kernechtrot |
5 Min. |
|
9. |
Kurz unter fließendem Wasser abspülen |
|
|
10. |
Entwässern, klären, eindecken |
Fehlerbehebung bei der Färbung mit kolloidalem Eisen und Umgang mit unspezifischer Hämosiderinfärbung:
- Zwei Objektträger A und B mit den gleichen Proben vorbereiten
- Inkubation von Objektträger A über das gesamte Protokoll
- Inkubation von Objektträger B nur nach Rehydratation in Kaliumferrocyanid/HCl-Lösung
- In der Auswertung von Objektträger B sind alle positiven Färbeergebnisse zu ignorieren, die auch auf Objektträger A zu sehen sind
3) Muzikarmin – Ein hochspezifischer Farbstoff für Muzin epithelialen Ursprungs
Lange bevor immunhistochemische Verfahren zur Verfügung standen, hat man Siegelringzellkarzinome über die Muzikarminfärbung identifiziert. In den Zellen dieser malignen Tumore bildet sich so viel Schleim, dass der Zellkern an den Rand gedrängt wird, was zur charakteristischen Form des Siegelrings führt.
Siegelringzellkarzinome lassen sich mithilfe dreier Methoden erkennen:

Die Muzikarminfärbung wird auch verwendet, um zwischen Muzin-negativen Plattenepithelkarzinomen und Muzin-positiven Adenokarzinomen zu unterscheiden.

Ein weiteres Beispiel für eine positive Muzikarminfärbung:

Die Methode
Karmin ist ein Farbstoff, der aus den Körpern von weiblichen Cochenilleschildläusen gewonnen wird. Sein wichtigster Bestandteil ist Karminsäure, die mit Aluminiumsalzen gebeizt wird, ganz ähnlich wie Hämatoxylin. Dabei entsteht ein positiv geladener Komplex, der von den negativ geladenen sauren Muzinen angezogen wird.

Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren
|
1 |
Objektträger in Wasser eintauchen |
|
|
2 |
Hämatoxylin nach Weigert |
5-10 Min. |
|
3 |
Unter fließendem Wasser abspülen |
|
|
4 |
Muzikarmin |
20-30 Min. |
|
5 |
Unter fließendem Wasser abspülen |
|
|
6 |
Metanilgelb |
1-3 Min. |
|
7 |
Kurz unter fließendem Wasser abspülen |
|
|
8 |
Entwässern, klären, eindecken |
Fehlerbehebung bei der Muzikarminfärbung:
Befolgen Sie beim Ansetzen der Muzikarminlösung die Anweisungen des Herstellers. Verwenden Sie nur geeignetes Wasser und richten Sie sich auch bezüglich der Verdünnung nach den Herstellerempfehlungen. Wenn Sie versuchen, mit unverdünntem Muzikarmin zu färben oder eine ungeeignete Lösung verwenden, werden Sie nicht die gewünschten Resultate erzielen. Auch eine längere Inkubationszeit kann diese Fehler nicht ausgleichen. Das Hämatoxylin nach Weigert sollte frisch angesetzt sein. Wenn es nicht mehr violett, sondern bräunlich erscheint, hat es sich zersetzt und wird keine zufriedenstellende Kernfärbung liefern. Einmal angesetztes Hämatoxylin nach Weigert sollte im Laufe desselben Tages verwendet werden, am Folgetag aber nicht mehr. Gehen Sie sparsam mit dem Metanilgelb um, das Sie zur Gegenfärbung nutzen.

Neutrale Muzine – die wichtigste Färbung
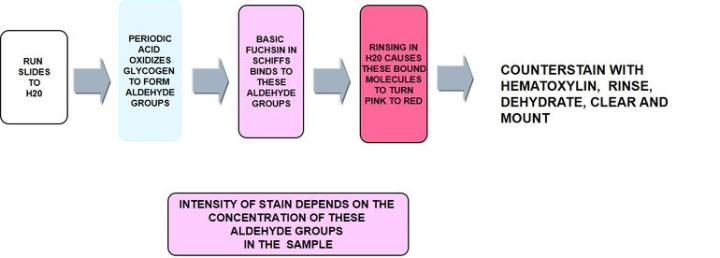
Perjodsäure-Schiff-Reaktion (PAS)
Die Perjodsäure-Schiff-Reaktion oder PAS-Färbung ist eine sehr vielseitige Kohlenhydratfärbung, mit der sich neben neutralen Muzine auch Glykogen darstellen lässt. Auch schwach saure Muzine in Epithelzellen werden angefärbt, wobei dafür nicht die negative Ladung der Muzine, sondern die Struktur der Kohlenhydratseitenketten entscheidend ist.
Die Methode
Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren
|
1 |
Objektträger in Wasser eintauchen |
|
|
2 |
Perjodsäure 0,5 % zur Oxidation |
5 Min. |
|
3 |
Schiff-Reagens |
15 Min. |
|
4 |
Unter fließendem Wasser abspülen |
5 Min. |
|
5 |
Mayers Hämatoxylin |
1 Min. |
|
6 |
Unter fließendem Wasser abspülen |
1 Min. |
|
7 |
Entwässern, klären, eindecken |
Saure Muzine und neutrale Muzine auf demselben Objektträger darstellen
Alcianblau / PAS
Die Methode
Alcianblau färbt die sauren Muzine an und die neutralen Muzine werden im Rahmen der PAS-Reaktion gefärbt.

Ergebnisse
Das Protokoll
Die Inkubationszeiten können in Abhängigkeit vom Hersteller variieren
|
1. |
Objektträger in Wasser eintauchen |
|
|
2. |
Alcianblau |
15 Min. |
|
3. |
Unter fließendem Wasser abspülen |
12 Min. |
|
4. |
Perjodsäure |
5 Min. |
|
5. |
Unter fließendem Wasser abspülen |
|
|
6. |
Schiff-Reagens |
10 Min. |
|
7. |
Unter fließendem Wasser abspülen |
5 Min. |
|
8. |
Mayers Hämatoxylin |
1 Min. |
|
9. |
Unter fließendem Wasser abspülen |
|
|
10. |
Entwässern, klären, eindecken |
Fehlerbehebung bei der Alcianblau/PAS-Färbung:
- Alcianblau-Lösung auf einen pH-Wert von 2,5 einstellen
- Sicherstellen, dass die Perjodsäure frisch angesetzt ist
- Schiff-Reagens gemäß den Angaben des Herstellers lagern
Glykogen
Glukose ist die wichtigste Energiequelle der Zellen. Glukose, die nicht sofort gebraucht wird, wird in eine Speicherform überführt und in Leber und Muskeln gespeichert. Diese Speicherform der Glukose wird als Glykogen bezeichnet. In Momenten, in denen Energie benötigt, aber keine Nahrung zugeführt wird, die Glukose liefern würde, wird Glykogen wieder zu Glukose abgebaut.
Wie Glykogen dargestellt werden kann:
Perjodsäure-Schiff-Reaktion – Mithilfe der PAS-Reaktion lässt sich Glykogen in der Leber, in den Basalmembranen, aber auch in bestimmten Nieren-, Blasen-, Eierstock- und Bauchspeicheldrüsentumoren sowie in Pilzen nachweisen.
Beispiele für Gewebe, das in der Regel eine positive PAS-Reaktion zeigen:


Die Präsenz von Glykogen und sein Verteilungsmuster sind für die Diagnose verschiedener Krankheiten relevante Befunde:
-
Glykogenspeicherkrankheiten,
-
darunter Morbus Pompe, wobei die Akkumulation von Glykogen eine generalisierte, fortschreitende Myopathie verursacht, die sich vor allem in Form einer Muskelschwäche manifestiert, aber auch das Herz, die Leber und das Nervensystem betreffen kann
-
Rhabdomyosarkom, eine bösartige Neubildung der Skelettmuskulatur
-
Mesotheliom
Die Methode

Fehlerbehebung bei der PAS-Reaktion:
Es ist wichtig, dass die Perjodsäure unverdünnt und entsprechend stark bleibt. Informieren Sie sich in der Produktinformation über die richtige Lagerung von Schiff-Reagens.
Wie sich Glykogen von anderen PAS-positiven Elementen unterscheiden lässt:
PAS-D – Perjodsäure-Schiff-Reaktion mit Diastasetest
Diastase ist ein Malzextrakt, das die Enzyme α- und β-Amylase enthält, die beide dem Abbau von Polysacchariden dienen. Heute bezeichnet man sowohl α- als auch β-Amylase als Diastase. Im Rahmen einer Diastase-Verdauung wird Glykogen in kleinere Zuckermoleküle aufgespalten, die dann ausgewaschen werden können.
So lässt sich eine Diastase-Verdauung durchführen, um Glykogen von anderen PAS-positiven Molekülen zu differenzieren:
- Bereiten Sie zwei Objektträger mit Schnitten derselben Probe vor.
- Behandeln Sie Objektträger A ausschließlich mit Wasser oder Puffer.
- Behandeln Sie Objektträger B mit Diastase (0,25 g α-Amylase in 50 ml destilliertem Wasser).
- Färben Sie beide Objektträger mit PAS gemäß dem oben beschriebenen Protokoll.
- Entwässern, klären, eindecken.
Ergebnisse:
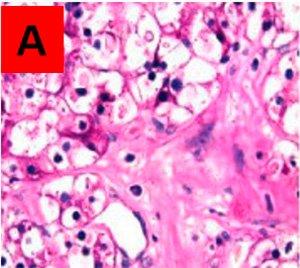

Bereiche, die auf dem unbehandelten Objektträger A PAS-positiv und auf dem behandelten Objektträger B PAS-negativ sind, entsprechen Glykogen. Im Gegensatz dazu bedeutet ein positives Ergebnis auf beiden Objektträgern, dass die angefärbte Substanz nicht vom Enzym abgebaut wurde und es sich demzufolge nicht um Glykogen handelt.
Fehlerbehebung bei PAS-D:
Vergewissern Sie sich, dass die Perjodsäure frisch angesetzt und das Schiff-Reagens stabil ist. Es macht definitiv einen Unterschied, ob Sie das richtige Enzym verwenden oder nicht. Verdünnen Sie das Enzym gemäß den Angaben im Protokoll und machen Sie sich klar, dass Glykogen das ist, was nach der Diastase-Verdauung nicht mehr zu sehen ist. Mit ein bisschen Ruhe ist das sehr gut nachvollziehbar.
Nebenbei: Menschlicher Speichel enthält Amylase und könnte in der PAS-D-Färbung anstelle der kommerziell erhältlichen Diastase eingesetzt werden.
About the presenter

Carolyn Doan received her ASCP registration in 1969 after completing classes at Georgia State University and St Joseph school of Histotechnology in Atlanta, Georgia. For 40 years she shared her passion for histology in research (at Yerkes Primate Research Center), in the clinical world (managing the Pathology Department at Florida Hospital in Orlando and serving on the board of the Florida State Licensure Task Force and as president of the Florida State Society for Histotechnology), and in industry (as a Sales executive, Marketing Manager and North American staining sales specialist). Since her retirement in 2013, she founded Creative Histology Consulting.
Referenzen
Rolls G. 101 Schritte zu einer besseren Histologie – Ein praktischer Leitfaden zur guten histologischen Praxis. Leica Biosystems Knowledge Pathway.
Dorst D. The Role of Mucopolysaccharides in Good Health. Aquaculture Inc., 2012.
Shaikh I. Special Stains in Histopathology. Kem Hospital, 2012.
Ellis R. Alcian Blue and PAS Staining Protocols. IMVS Division of Pathology, The Queen Elizabeth Hospital, Woodville, South Australia.
Mowry, RW. Alcian blue technics for the histochemical study of acidic carbohydrates. J Histochem Cytochem, 1956;4;407.
Myers R. Spezielle Färbetechniken für die Bewertung von Muzinen. Leica Biosystems Knowledge Pathway.
Pernick N. Muzins. Pathology Outlines, January 26, 2016
Sheehan D, Hrapchak B. Theory And Practice Of Histotechnology. 2nd ed. Ohio: Battelle Press, 1987.
Die Inhalte des Knowledge Pathway von Leica Biosystems unterliegen den Nutzungsbedingungen der Website von Leica Biosystems, die hier eingesehen werden können: Rechtlicher Hinweis. Der Inhalt, einschließlich der Webinare, Schulungspräsentationen und ähnlicher Materialien, soll allgemeine Informationen zu bestimmten Themen liefern, die für medizinische Fachkräfte von Interesse sind. Er soll explizit nicht der medizinischen, behördlichen oder rechtlichen Beratung dienen und kann diese auch nicht ersetzen. Die Ansichten und Meinungen, die in Inhalten Dritter zum Ausdruck gebracht werden, spiegeln die persönlichen Auffassungen der Sprecher/Autoren wider und decken sich nicht notwendigerweise mit denen von Leica Biosystems, seinen Mitarbeitern oder Vertretern. Jegliche in den Inhalten enthaltene Links, die auf Quellen oder Inhalte Dritter verweisen, werden lediglich aus Gründen Ihrer Annehmlichkeit zur Verfügung gestellt.
Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.